
| A. | 分离对硝基甲苯和邻硝基甲苯:蒸馏 | |
| B. | 除去甲基丙烯酸甲酯中少量甲醇:蒸馏 | |
| C. | 除去漠苯中少量水:分液 | |
| D. | 从粗产品中提纯苯甲酸钠:重结晶 |
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有② | C. | 只有③ | D. | 只有②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
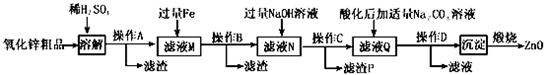
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
| 样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
| CO2的体积(mL) | 672 | 840 | 896 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000wd}{M(w+1000)}$ mol•L-1 | B. | $\frac{wd}{Mw+1000}$mol•L-1 | ||
| C. | $\frac{w}{M}$mol•L-1 | D. | $\frac{1000wd}{wM+1000}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 只有①④⑤ | C. | 只有②③ | D. | 只有③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH | B. | CH3COOCH2CH3 | C. | CH2=CHCOOH | D. | 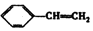 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
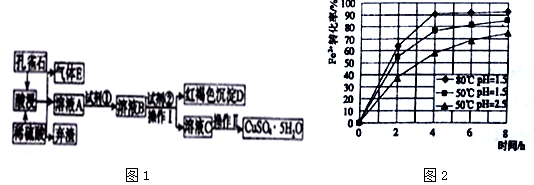
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
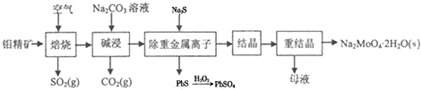
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com