
 甲苯(
甲苯(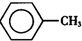 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(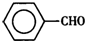 )、苯甲酸(
)、苯甲酸(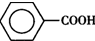 )等
)等| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
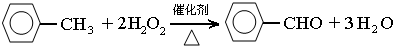 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.分析 (1)由仪器a结构可知为球形冷凝管,甲苯挥发会导致产率降低;
三颈瓶中甲苯被过氧化氢氧化生成苯甲醛,同时还生成水;
原子利用率=(预期产物的总质量÷全部反应物的总质量)×100%;
(2)但温度过高时过氧化氢分解,实际参加反应的过氧化氢质量减小;
(3)反应完毕后,反应混合液经过自然冷却至室温时,先过滤分离固体催化剂,再利用蒸馏的方法分离出苯甲酸;
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸.
①先与碳酸氢钠反应之后为苯甲酸钠,再分液分离,水层中加入盐酸得到苯甲酸晶体,最后过滤分离得到苯甲酸;
②苯甲酸的物质的量等于消耗KOH物质的量,再计算产品中苯甲酸的质量分数;
a.滴定时俯视读取耗碱量,会使KOH溶液体积读数偏小;
b.KOH标准液长时间接触空气,会吸收二氧化碳步骤转化为碳酸钾,导致消耗氢氧化钾溶液体积偏大;
c.配置KOH标准液时仰视定容,液面在刻度线上方,配制标准液的体积偏大、浓度偏小,导致滴定时消耗KOH溶液体积偏大;
d.将酚酞指示剂换为甲基橙溶液,终点时溶液呈酸性,消耗氢氧化钾溶液体积偏小.
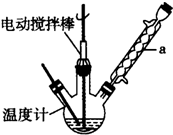
解答 解:(1)由仪器a结构可知为球形冷凝管,甲苯挥发会导致产率降低,冷凝回流,防止甲苯挥发导致产率降低;
三颈瓶中甲苯被过氧化氢氧化生成苯甲醛,同时还生成水,反应方程式为: ,此反应中原子利用率=$\frac{106}{160}$×100%=66.25%;
,此反应中原子利用率=$\frac{106}{160}$×100%=66.25%;
故答案为:球形冷凝管;冷凝回流,防止甲苯挥发导致产率降低; ;66.25%;
;66.25%;
(2)但温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,苯甲醛的产量却有所减少,
故答案为:温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,影响产量;
(3)反应完毕后,反应混合液经过自然冷却至室温时,先过滤分离固体催化剂,再利用蒸馏的方法分离出苯甲酸,
故答案为:过滤、蒸馏;
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸.
①先与碳酸氢钠反应之后为苯甲酸钠,再分液分离,水层中加入盐酸得到苯甲酸晶体,最后过滤分离得到苯甲酸,再洗涤、干燥得到苯甲酸,故正确的操作步骤是:dacb,
故答案为:dacb;
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mo/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL.
苯甲酸的物质的量等于消耗KOH物质的量,则2.500g产品中苯甲酸为0.018L×0.1mol/L×$\frac{200mL}{20mL}$×122g/mol=2.196g,产品中苯甲酸的质量分数为$\frac{2.196g}{2.5g}$×100%=87.84%;
a.滴定时俯视读取耗碱量,会使KOH溶液体积读数偏小,计算苯甲酸的质量偏小,测定结果偏低,故a符合;
b.KOH标准液长时间接触空气,会吸收二氧化碳步骤转化为碳酸钾,导致消耗氢氧化钾溶液体积偏大,测定结果偏高,故b不符合;
c.配置KOH标准液时仰视定容,液面在刻度线上方,配制标准液的体积偏大、浓度偏小,导致滴定时消耗KOH溶液体积偏大,测定结果偏高,故c不符合;
d.将酚酞指示剂换为甲基橙溶液,终点时溶液呈酸性,消耗氢氧化钾溶液体积偏小,测定结果偏低,故d符合,
故答案为:87.84%;ad.
点评 本题考查有机物合成实验、物质的分离提纯、实验方案设计、对操作的分析评价、物质含量测定等,较好的考查学生对数据的应用、阅读获取信息的能力以及知识迁移应用,难度中等.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:多选题
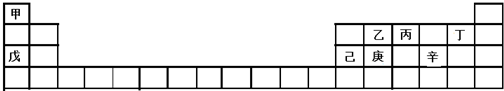
| A. | 甲、戊、己的单质都是金属 | |
| B. | 乙、丙、丁的氢化物稳定性依次增强 | |
| C. | 庚的氧化物不能和丁的氢化物反应 | |
| D. | 己的氧化物能分别与戊和辛的最高价氧化物的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “青篙一握,以水二升渍,绞取汁”,该过程是对青篙素的提取,属于化学变化 | |
| B. | 向漂白粉溶液中滴加少量醋酸,漂白速率会加快 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
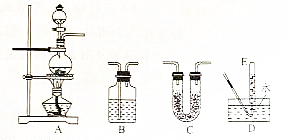
| 选用的仪器 | 加入的试剂 |
| A | 二氧化锰、浓硫酸、食盐 |
| B | 饱和食盐水 |
| B | KBr溶液和CCl4的混合液 |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
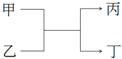 甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )
甲和丙为短周期、同主族元素组成的单质,乙和丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可能是下列各组物质中的( )| A. | H2和Na | B. | S和O2 | C. | C和Si | D. | Cl2和Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 供电时的总反应是:2H2+O2=2H2O | |
| B. | 产物为无污染的水,属于环境友好电池 | |
| C. | 燃料电池的能量转化率无法达到100% | |
| D. | H2在负极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HClO的结构式:H-O-Cl | B. | 纯碱的化学式为:Na2CO3 | ||
| C. | 原子核内有8个中子的碳原子148C | D. | Na2O2电子式为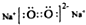 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成化合物时,X显负价,Y显正价 | |
| B. | 电负性X>Y | |
| C. | 最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 | |
| D. | 失去第一个电子消耗能量:X>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com