
【题目】将4mol A气体和2mol B气体在2L的密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)2C(g)若经过2秒后测得C的浓度为0.6mol/L.则:
(1)2s内用B表示的反应速率
(2)2s时A的物质的量浓度为
(3)2s时B的物质的量为
(4)最终C的浓度(填“能”或“不能”)达到2mol/L.
【答案】
(1)0.15mol/(L?s)
(2)1.4mol/L
(3)1.4mol
(4)不能
【解析】解:依据化学平衡三段式列式计算,若经过2秒后测得C的浓度为0.6mol/L.生成C物质的量=0.6mol/L×2L=1.2mol,
2A(g) | + | B(g) | 2C(g) | ||
起始量(mol) | 4 | 2 | 0 | ||
变化量(mol) | 1.2 | 0.6 | 1.2 | ||
平衡量(mol) | 2.8 | 1.4 | 1.2 |
(1.)2s内用B表示的反应速率= ![]() =0.15 mol/(Ls);所以答案是:0.15 mol/(Ls);(2.)2s时A的物质的量浓度=
=0.15 mol/(Ls);所以答案是:0.15 mol/(Ls);(2.)2s时A的物质的量浓度= ![]() =1.4mol/L;所以答案是:1.4mol/L;
=1.4mol/L;所以答案是:1.4mol/L;
(3.)计算可知2s时B的物质的量为1.4mol;所以答案是:1.4mol;
(4.)最终C的浓度若为2mol/L,需要4molA全部反应生成C4mol,但最后达到平衡状态是可逆反应,不能进行彻底,所以不能达到2mol/L;所以答案是:不能;
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】分子式C4H8O2的有机物与硫酸溶液共热可得有机物A和B。将A氧化最终可得C,且B和C为同系物。若B可发生斐林反应,则原有机物的结构简式为
A.HCOOCH2CH2CH3 B.CH3COOCH2CH3
C.CH3CH2COOCH3 D.HOCH2CH2CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) △H
CH3OH(g) △H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)
温度/0C | 270 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H_______0(填“>”“=”或“<”)
②某温度下,将2 molCO和6 mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol·L-1,则CO的转化率为___________,此时的温度为___________。
(2)要提高CO的转化率,可以采取的措施是____________(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(3)3000C时,在2L的密闭容器中充入2 mol CO,2mol CH3OH,6mol H2,则此时![]() 正__
正__![]() 逆(填“>”“<”“=” )
逆(填“>”“<”“=” )
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题的重点。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T10C时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T20C时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T30C时催化效率最高,能使正反应速率加快约3×106倍;
已知:T1>T2>T3,根据上述信息,写出你认为在生产中应该选择的适宜催化剂并简述理由:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于塑料的下列说法中,不正确的是 ( )
A. 在日常生活中用于包装食品的塑料通常是聚乙烯
B. 有机玻璃是一种透光性好的塑料制品
C. 塑料制品容易被微生物分解,所以废弃塑料制品不会对环境造成严重的污染
D. 塑料的主要成分是合成树脂,另外还有一些添加剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠及其化合物的说法不正确的是( )
A.金属钠化学性质十分活泼
B.实验室中,常将钠保存在石蜡油或煤油中
C.金属钠与水反应,钠沉在水面下,反应剧烈
D.过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是( )
A. 纤维素、脂肪 B. 蛋白质、高级烃 C. 淀粉、油脂 D. 蛋白质、硬化油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据下图所示装置完成以下练习:
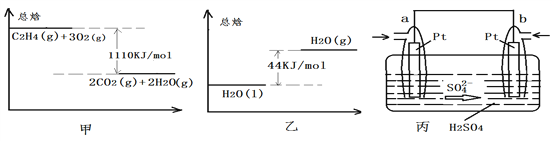
(1)写出298K时C2H4气体在氧气中完全燃烧生成气态水时的热化学方程式: ________________.
(2)写出298K时C2H4气体在氧气中完全燃烧生成液态水时的热化学方程式:__________________.
(3)现在把C2H4在空气中燃烧的反应设计成如丙图中所示的燃料电池,则a口通入的气体是_________,该极的电极反应式为:____________________________
(4)b电极上发生的电极反应式为:______________________________________.
(5)碱性镉镍可充电电池的总反应为:![]() 则该电池充电时的阴极反应为:__________________________________________
则该电池充电时的阴极反应为:__________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com