
【题目】电浮选凝聚法是工业上采用的一种污水处理方法;保持污水的pH在5.0~6.0之间,利用电解过程中生成的Fe(OH)3沉淀的吸附性吸附污物而沉积下来,模拟处理装置如下。下列有关说法中错误的是
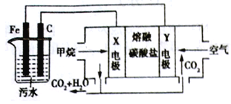
A. X电极是负极,电极反应式为:CH4-8e-+4CO32-=5CO2+2H2O
B. 铁是阳极,先失去电子生成Fe2+
C. 工作时熔融碳酸盐中的CO32-移向Y电极
D. 污水中存在反应4Fe2++10H2O+O2=4Fe(OH)3+8H+
科目:高中化学 来源: 题型:
【题目】图(1)和图(2)是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图(1)和图(2)两种物质的核磁共振氢谱图选择出可能属于图(1)和图(2)的两种物质( )

A. A是C3H6;B是C6H6
B. A是C2H6;B是C3H6
C. A是C2H6;B是C6H6
D. A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:

已知:①A的相对分子量为58,氧元素质量分数为0. 276,核磁共振氢谱显示为单峰;

回答下列问题:
(1)A的化学名称为____________。
(2)G的结构简式为________________,G中的含氧官能团是________________。(填官能团名称)
(3)由B生成C的反应类型为_______________,由C生成D的反应类型为_____________。
(4)由E生成F的化学方程式为________________________________。
(5)H的同分异构体中,含有酯基,能发生银镜反应、核磁共振氢谱之比是1:1:3的同分异构体结构简式_____________________________________________。(写两种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸(H3PO3)是二元弱酸,亚磷酸主要用作尼龙增白剂,电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图(其中阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法不正确的是

A. 阳极的电极反应式为2H2O-4e-![]() 4H++O2↑
4H++O2↑
B. 产品室中发生的离子反应为HPO32-+2H+![]() H3PO3
H3PO3
C. 原料室中Na+浓度保持不变
D. 阴极室中溶液的pH逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。

已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图所示的转化关系(部分生成物和反应条件已略去):
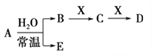
(1)元素⑧的最高价氧化物对应水化物的化学式是_________________________。
(2)元素⑤与As两种元素中,简单气态氢化物较稳定的是___________(填化学式)。
(3)元素②⑥⑦的简单离子半径由大到小的顺序是___________(用化学符号表示)。
(4)元素③的单质与元素②的最高价氧化物对应的水化物反应的离子方程式是________________。
(5)若A为红棕色气体,则X、D的化学式分别为___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。

请回答下列问题:
(1)下列相关说法中,正确的是________(填序号)。
a.N4是N2的同分异构体
b.1 mol N4分解生成N2,形成了4 molπ键
c.白磷的沸点比N4高,是因为P-P键键能比N-N键能大
d.白磷的化学性质比N2活泼,说明P的非金属性比N强
(2)已知白磷、NH4+ 、N4H44+的空间构型均为四面体结构,参照NH4+和白磷的结构式,画出N4H44+的结构式(配位键用![]() 表示)________________;
表示)________________;
(3)在叶绿素结构示意图上标出N与Mg元素之间的配位键和共价键(配位键用![]() 表示)_______
表示)_______
(4)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3)等。根据等电子体理论写出N3-的电子式_____________;叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钴显____价,它的配体是 ________________,写一种与SO42-等电子体的分子 ________________。
(5)六方相氮化硼晶体内B-N键数与硼原子数之比为_______,其结构与石墨相似却不导电,原因是_______________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
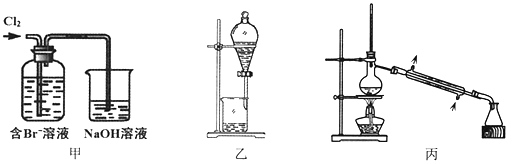
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鸦片具有复杂的组成,其中的罂粟碱的分子结构如图。鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾,使人体质衰弱,精神颓废,寿命缩短。已知该物质的燃烧产物为CO2、H2O和N2,1 mol该化合物完全燃烧消耗O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物同分异构体的种数分别是
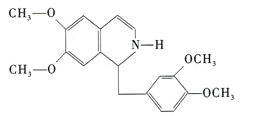
A. 23.75 mol;5 B. 24.5 mol;7 C. 24.5 mol;8 D. 23.75 mol;4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com