
【题目】下列有关反应X+2Y=X2++2Y-的叙述中正确的是
A. X被氧化,Y是氧化剂 B. Y被还原,X是氧化剂,
C. X是还原剂,Y被氧化 D. Y被还原,X2+是还原产物
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】(1)请你将反应Cu+2FeCl3==CuCl2+2FeCl2设计成原电池并回答下列问题:
①写出电极反应式:正极_____________________;负极_________________________。
②画出你所设计的原电池简易装置图_________。
(2)该电池向外提供0.2mol 电子,负极材料的质量变化为________________________。
(3)利用反应2Cu+O2+2H2SO4==2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极的反应式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
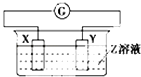
【题目】X、Y两根金属棒插入Z溶液中构成如图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )
编号 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硝酸银溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子aA3+、bB+、cC2-、dD- 都具有相同的电子层结构 ,则下列叙述中正确的是 ( )
A. 原子半径:A>B>D>C B. 原子序数:d>c>b>a
C. 离子半径:C>D>B>A D. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示. 则反应:A(g)+B(g)=2C(g)( )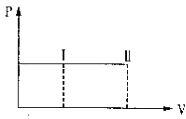
A.是放热反应
B.反应后气体总分子数增多
C.是吸热反应
D.反应物具有的总能量等于生成物具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)CO2(g)+H2(g),部分数据见表(表中t2>t1),说法错误的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
A.反应在t1min末的速率为v(H2)=0.2/t molL﹣1min﹣1
B.平衡时水蒸气的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时水蒸气的转化率为33.33%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A的元素符号__________;D的原子结构示意图_______________。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是(元素符号)__________。
(3)CA2与D元素的单质在水溶液中反应的化学方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程 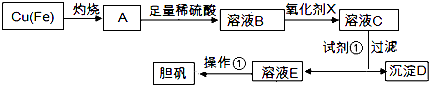
已知:
溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)下列物质中最适宜做氧化剂X的是 (填字母).
A.NaClO
B.H2O2
C.KMnO4
(2)加入试剂①是为了调节pH,试剂①可以选择(填化学式).
(3)操作①的名称是 .
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是 .
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是(用离子方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大.①A元素最外层电子数是次外层电子数的2倍.②B的阴离子和C的阳离子与氖原子的电子层结构相同.③在通常状况下,B的单质是气体,0.1mol B的气体与足量的氢气完全反应共有0.4mol电子转移.④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质.⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应.请写出:
(1)A元素的最高价氧化物的结构式;B元素在周期表中的位置 .
(2)C单质在B单质中燃烧的生成物中所含化学键类型有;C与D 能形成化合物的电子式 .
(3)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为 .
(4)元素D与元素E相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填选项序号). a.常温下D的单质和E的单质状态不同 b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应 d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com