
| A. | CH2═CH-CN | B. | CH2═CH-CH═CH2 | C. |  -CH═CH2 -CH═CH2 | D. | 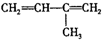 |
分析 根据苯环为平面结构、乙烯为平面结构以及乙炔为直线结构来分析各物质的共面原子.
解答 解:A.CH2=CHCN相当于乙烯分子中的一个氢原子被-CN取代,不改变原来的平面结构,-C≡N中两个原子在同一直线上,这两个平面可以是一个平面,所以该分子中所有原子可能在同一平面上,故A正确;
B.CH2=CH-CH=CH2相当于乙烯分子中的一个氢原子被乙烯基取代,不改变原来的平面结构,乙烯基的所有原子在同一个面上,这两个平面可以是一个平面,所有原子可能都处在同一平面上,故B正确;
C.苯为平面结构,苯乙烯相当于苯环上的一个氢被乙烯基取代,不改变原来的平面结构,乙烯基的所有原子在同一个面上,这两个平面可以是一个平面,所以所有原子可能都处在同一平面上,故C正确;
D.该分子相当于甲烷中的一个氢原子被1,3-二丁烯2-丁基取代,甲烷是正四面体结构,所以甲烷中所有原子不可能在同一平面上,故D错误.
故选D.
点评 本题考查了有机物的共面知识的认识,难度较大,分析时可根据已学过的甲烷、乙烯、苯的结构来类比判断.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25%和7.5akJ | B. | 25%和3bkJ | C. | 75%和(a-b) kJ | D. | 75%和(10a-b) kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易溶盐不存在沉淀溶解平衡 | |
| B. | 可通过调节溶液pH或加入沉淀剂使某些金属离子沉淀 | |
| C. | 某离子在溶液中沉淀完全,则该离子在溶液中已不存在 | |
| D. | 一般,溶解度小的易转化成溶解度更小的,而溶解度更小的不能转化成溶解度小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 说明甲醛是具有氧化性的气体 | B. | 反应中甲醛被还原 | ||
| C. | 最终酸性高锰酸钾溶液是红色 | D. | 最终酸性高锰酸钾溶液是无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
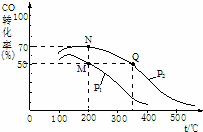 减少污染、保护环境是全世界最热门的课题.请回答下列问题:
减少污染、保护环境是全世界最热门的课题.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com