
| A. | NaHCO3(溶液):NaHCO3═Na++H++CO32- | |
| B. | NaHSO4(溶液):NaHSO4═Na++H++SO42- | |
| C. | (NH4)2SO4(溶液):(NH4)2SO4═(NH4)2++SO42- | |
| D. | CuCl2(溶液):CuCl2═Cu2++Cl2- |
分析 A.碳酸氢钠为强电解质,完全电离,注意碳酸氢根离子为弱酸的酸式根离子不能拆;
B.NaHSO4是强酸强碱酸式盐,属强电解质,溶液中完全电离,电离出Na+、H+、SO42-离子;
C.硫酸铵电离出铵根离子和硫酸根离子,注意化学式中原子团右下角数字在电离方程式中应转写成系数;
D.氯离子书写错误,氯离子带一个单位的负电荷.
解答 解:A.碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,故A错误;
B.硫酸氢钠属于二元强酸硫酸的酸式盐,能完全电离:NaHSO4=Na++H++SO42-,故B正确;
C.硫酸铵电离出铵根离子和硫酸根离子,电离方程式为:(NH4)2SO4═2NH4++SO42-,故C错误;
D.氯化铜电离出铜离子和氯离子,电离方程式为:CuCl2═Cu2++2Cl-,故D错误;
故选B.
点评 本题考查电解质的电离方程式书写,题目难度不大,掌握电离方程式书写规则并能灵活运用是正确解答此类题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
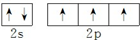 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将FeCl3固体放入水中搅拌 | |
| B. | 向FeCl3溶液中加入NaOH溶液 | |
| C. | 加热FeCl3溶液 | |
| D. | 向沸水中滴加饱和FeCl3溶液,并加热至红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
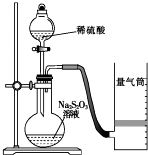 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
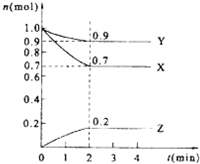 某温度时,在5L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示.
某温度时,在5L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com