
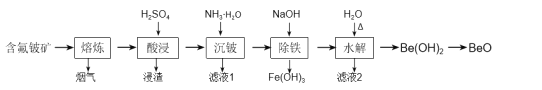
【题目】铍是原子能、火箭、导弹、航空、宇宙航行以及冶金工业中不可缺少的一种新兴材料。以某地的含氟铍矿(主要成分为BeO、CaF2、Al2O3、Fe2O3、SiO2及少量的硫酸盐)为原料,生产工业氧化铍的一种工艺流程如图:
已知:①25℃,Ksp(CaCO3)=8.7×10-9;Ksp(CaSO4)=2.5×10-5;
②Be(OH)2与Al(OH)3性质相似。
回答下列问题:
(1)“熔炼”的温度为1600℃,其中约20%的Al2O3反应生成烟气(主要成分为AlF3),该反应的化学方程式为___。
(2)浸渣的主要成分为CaSO4、___。
(3)加入氨水中和酸浸液,若将pH调至8~9,“沉铍”时产生的沉淀物主要有:___、___、___。
(4)“沉铍”后将滤渣加入足量氢氧化钠溶液提高pH进行“除铁”,铍元素参与反应的离子方程式为___,然后加适量水稀释进行“水解”,目的是___。
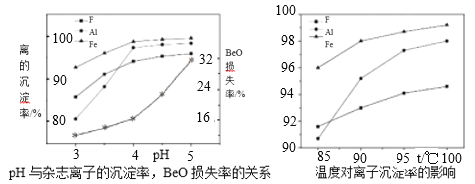
(5)若为高氟铍矿,需在“沉铍”前进行“除氟”。工业上“除氟”是加入10%的氨水,并控制一定的条件,使氟与铝铁形成共沉淀物而除去。根据如图实验数据,选择的实验条件为pH=___,水浴加热温度T=___℃。
(6)氧化铍粗产品含有一定量的硫酸盐会影响铍的后续冶炼,可用碳酸盐脱除,发生反应:CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)。通过计算反应的K值说明用碳酸钠脱硫酸根反应的程度大小:__。
【答案】Al2O3+3CaF2![]() 2AlF3↑+3CaO SiO2 Fe(OH)3 Be(OH)2 Al(OH)3 Be(OH)2+2OH-=BeO22-+H2O或Be(OH)2+2OH-=Be(OH)42- 稀释使溶液的碱性变弱,BeO22-水解,分离除去沉淀中的铝元素 4 95 K=
2AlF3↑+3CaO SiO2 Fe(OH)3 Be(OH)2 Al(OH)3 Be(OH)2+2OH-=BeO22-+H2O或Be(OH)2+2OH-=Be(OH)42- 稀释使溶液的碱性变弱,BeO22-水解,分离除去沉淀中的铝元素 4 95 K=![]() =
= =2.9×103,K值很大,说明转化反应程度很大
=2.9×103,K值很大,说明转化反应程度很大
【解析】
含氟铍矿(主要成分为BeO、CaF2、Al2O3、Fe2O3、SiO2及少量的硫酸盐)经过熔炼,发生反应Al2O3+3CaF2![]() 2AlF3↑+3CaO,“熔炼”后的主要成分BeO、CaF2、Al2O3、Fe2O3、SiO2、CaO与硫酸反应,因SiO2与硫酸不反应,而CaSO4微溶于水,则“酸浸”除去二氧化硅等,“酸浸”后滤液中的离子主要为H+、Fe3+、Be2+、Al3+、SO42-等,“沉铍”后Fe3+、Be2+、Al3+转化为沉淀Fe(OH)3、Be(OH)2、Al(OH)3,加入氢氧化钠后Be(OH)2、Al(OH)3溶解生成BeO22-、AlO2-并除去氢氧化铁,最后加适量的水稀释使溶液的碱性变弱,让BeO22-水解转化为Be(OH)2水解得到氢氧化铍。
2AlF3↑+3CaO,“熔炼”后的主要成分BeO、CaF2、Al2O3、Fe2O3、SiO2、CaO与硫酸反应,因SiO2与硫酸不反应,而CaSO4微溶于水,则“酸浸”除去二氧化硅等,“酸浸”后滤液中的离子主要为H+、Fe3+、Be2+、Al3+、SO42-等,“沉铍”后Fe3+、Be2+、Al3+转化为沉淀Fe(OH)3、Be(OH)2、Al(OH)3,加入氢氧化钠后Be(OH)2、Al(OH)3溶解生成BeO22-、AlO2-并除去氢氧化铁,最后加适量的水稀释使溶液的碱性变弱,让BeO22-水解转化为Be(OH)2水解得到氢氧化铍。
(1)根据元素守恒分析,Al2O3转化为烟气AlF3,应为Al2O3与CaF2发生复分解反应:Al2O3+3CaF2![]() 2AlF3↑+3CaO。
2AlF3↑+3CaO。
(2)“熔炼”后适当冷却加入硫酸进行“酸浸”,主要是含氟铍矿中各种氧化物BeO、CaF2、Al2O3、Fe2O3、SiO2、CaO与硫酸反应,因SiO2与硫酸不反应,而CaSO4微溶于水,故浸渣的主要成分为CaSO4、SiO2。
(3)酸浸后滤液中的离子主要为H+、Fe3+、Be2+、Al3+、SO42-等,加入氨水中和酸浸液,pH调至8~9时,Fe3+、Be2+、Al3+转化为沉淀Fe(OH)3、Be(OH)2、Al(OH)3。
(4)“沉铍”后将滤渣加入足量氢氧化钠溶液提高pH进行“除铁”,因Fe(OH)3不与氢氧化钠反应,Be(OH)2、Al(OH)3性质相似为两性氢氧化物能与氢氧化钠溶液反应,发生Be(OH)2+2OH-=BeO22-+H2O、Al(OH)3+OH-=AlO2-+2 H2O,将Fe(OH)3分离,溶液中阴离子主要是BeO22-、AlO2-,后加适量水稀释进行“水解”,根据流程中的得到的信息“水解”目的是得到Be(OH)2,故说明流程中加适量的水是稀释使溶液的碱性变弱,让BeO22-水解转化为Be(OH)2,分离除去沉淀中的铝元素。
(5)若为高氟铍矿则“酸浸”后溶液中含有大量的氟离子,氟离子浓度偏大会与Be2+形成配合物溶于水而增加了铍的损失率,因此需在“沉铍”前进行“除氟。根据题目信息工业上“除氟”是加入10%的氨水,并控制一定的条件,使氟与铝铁形成共沉淀物而除去。图1明显在pH=4时F、Al、Fe的沉淀率高,但pH高于4时,铍的损失率增大,故实验条件为pH=4,由图2看出温度在95℃后杂质离子的除去率高,故水浴加热温度为95℃。
(6)反应:CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)的K=![]() =
= =2.9×103,因为K值很大,说明CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)反应程度很大。
=2.9×103,因为K值很大,说明CaSO4(s)+Na2CO3(aq)=CaCO3(s)+Na2SO4(aq)反应程度很大。


科目:高中化学 来源: 题型:
【题目】某小组在实验室探究Ba(OH)2溶液与稀盐酸反应的实质。向0.2mol/L Ba(OH)2溶液中滴加0.1mol/L盐酸,测定导电率的变化如图所示,回答下列问题:

(1)Ba(OH)2在水中以离子形式存在的实验证据是___________。Ba(OH)2的电离方程式为___________。
(2)A-B段,发生的离子反应是__________。
(3)B点恰好完全反应,此时溶液中存在的微粒有H2O、__________。
(4)下列化学反应的实质与Ba(OH)2溶液与稀盐酸反应的实质相同的是__________。
A. Ba(OH)2和H2SO4 B. NaOH和H2SO4 C. Ba(OH)2与HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。

(1) 写出铅酸蓄电池放电时正极的电极反应式:________,放电时,H+向电池______极定向移动(填“正”或“负”)。
(2) 传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为________。
(3) 铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是________(元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是________(填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA 表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,4gH2含有的分子数为2NA
B.17g氨气所含电子数目为8NA
C.将1体积c1mol/L的硫酸溶于4体积水中 ,稀溶液的浓度为0.2c1mol/L
D.将5.85gNaCl 晶体溶入100mL水中,制得0.1mol/L的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯( NOCl) 是有机合成中的重要试剂,为黄色气体或红褐色液体(熔点- 64. 5℃,沸点-5.5℃),具有刺鼻恶臭味,遇水和潮气水解,有多种方法制备。
(1)方法一:将5 g 经300℃下干燥了 3h 并研细的 KCl 粉末装入 50 mL 带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压下通入0. 002 mol NO2。反应 12 ~ 36 min 即可完成,NO2红棕色消失 ,出现黄色亚硝酰氯,同时还得到一种盐。写出亚硝酰氯的电子式________,该方法制备NOCl的化学方程式为_________________,氯化钾需要“干燥”的原因是_______________。
(2)方法二:实验室可用如图装置制备亚硝酰氯(NOCl),检验装置气密性并装入药品打开 K2,然后再打开___________(填“K1 ”或"“K3 ”) 通入一段时间气体,其目的为______,然后进行其他操作,当 Z 有一定量液体生成时,停止实验。写出X 装置中反应的离子方程式_____________________ 。

(3)测定产品纯度:取(2)中w g Z 中液态产品溶于蒸馏水,配制成250 ml 溶液;用酸式滴定管准确量取25. 00mL 所配溶液于锥形瓶中,滴加几滴 K2CrO4溶液作指示剂,用滴定管盛装 c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液体积为V mL。[已知:Ksp( AgCl ) =1.56 ×10-10 ,Ksp(Ag2CrO4)=1×10-12,Ag2CrO4为砖红色固体,忽略杂质参与反应]
①盛装AgNO3 标准溶液的滴定管是____(填“酸式”或“碱式”)棕色滴定管;判断达到滴定终点的方法是_____________________。
②该产品纯度为_____________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太和一中理化创新社的同学们为了探究在实验室制备![]() 的过程中有水蒸气和
的过程中有水蒸气和![]() 挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。

(1)若用含有![]() 的浓盐酸与足量的
的浓盐酸与足量的![]() 反应制
反应制![]() ,制得的
,制得的![]() 体积(标准状况下)总是小于
体积(标准状况下)总是小于![]() 的原因是_____________________。
的原因是_____________________。
(2)①装置B的作用是_______________________,现象是_____________________。
②装置C和D出现的不同现象说明的问题是__________________________。
③装置E的作用是_______________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入![]() 溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入
溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入![]() 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在_________与_________之间(填装置字母序号),装置中应放入___________________________。
溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在_________与_________之间(填装置字母序号),装置中应放入___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究团队在优化催化剂的基础上,通过调节电极的孔道和疏水性增加CO的扩散速率,实现了高选择性将CO电解还原制备乙烯,如图所示。下列叙述错误的是( )
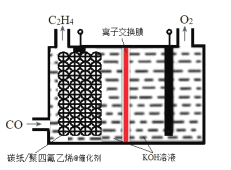
A.碳纸/聚四氟乙烯电极为阴极
B.聚四氟乙烯的作用是吸附并增加CO的浓度
C.为了维持电解的效率,离子交换膜应为阳离子交换膜
D.碳纸上生成C2H4的电极反应式为:2CO+6H2O+8e-=C2H4+8OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
A. 分子总数为NA的二氧化硫和二氧化碳混合气体中含有的原子数为3NA
B. 任何条件下,20 L 氧气含有的分子数都不可能为NA
C. 在标准状况下,2 g氖气含有NA个氖原子
D. 物质的量相等的任何气体中都含有相同的原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的叙述中,正确的是( )
A.NaHCO3俗名纯碱,Na2CO3俗名苏打
B.受热时,NaHCO3比Na2CO3容易分解
C.NaHCO3溶液显酸性,Na2CO3溶液显碱性
D.NaHCO3和Na2CO3各1mol分别与过量盐酸充分反应,产生CO2的质量不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com