
【题目】如图所示是制取无水氯化铜的实验装置图,将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题:

(1)盛放浓盐酸的仪器名称为__。
(2)烧瓶中发生反应的离子方程式为__。
(3)C瓶中的试剂是__,其作用是__。
(4)玻璃管D中发生反应的化学方程式是__,反应现象是__。
(5)干燥管E中盛有碱石灰(CaO+NaOH),其作用是__。
【答案】分液漏斗 4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O 浓硫酸 干燥氯气 Cu+Cl2
Mn2++Cl2↑+2H2O 浓硫酸 干燥氯气 Cu+Cl2![]() CuCl2 产生棕黄色的烟 吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D
CuCl2 产生棕黄色的烟 吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D
【解析】
(1)盛放浓盐酸的仪器是分液漏斗;
(2)装置A是制取氯气的发生装置,烧瓶中发生的反应是二氧化锰与浓盐酸在加热的条件下生成氯化锰、氯气与水;
(3)实验制取无水氯化铜,进入装置D的氯气应干燥,装置C的作用是干燥氯气,盛放的试剂是浓硫酸;
(4)玻璃管D中Cu与氯气反应制取氯化铜,铜与氯气反应生成氯化铜,产生棕黄色的烟;
(5)氯气有毒,反应后的尾气中含有氯气,直接排放到空气中会污染大气;实验制备无水氯化铜,空气中的水蒸气进入装置D会影响无水氯化铜的制备。
(1)盛放浓盐酸的仪器是分液漏斗;
(2)装置A是制取氯气的发生装置,烧瓶中发生的反应是二氧化锰与浓盐酸在加热的条件下生成氯化锰、氯气与水,反应方程式为:4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O,则发生反应的离子方程式为4H++2Cl-+MnO2
MnCl2+Cl2↑+2H2O,则发生反应的离子方程式为4H++2Cl-+MnO2![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)实验制取无水氯化铜,进入装置D的氯气应干燥,装置C的作用是干燥氯气,盛放的试剂是浓硫酸;
(4)玻璃管D中Cu与氯气反应制取氯化铜,铜与氯气反应生成氯化铜,反应方程式为:Cu+Cl2 ![]() CuCl2,反应现象是:产生棕黄色的烟;
CuCl2,反应现象是:产生棕黄色的烟;
(5)氯气有毒,反应后的尾气中含有氯气,直接排放到空气中会污染大气;实验制备无水氯化铜,空气中的水蒸气进入装置D会影响无水氯化铜的制备,故干燥管E中盛有碱石灰,其作用是:吸收尾气中未反应的氯气和防止空气中水蒸汽进入装置D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式不正确的是( )
A.铝片放入NaOH溶液中有气体产生:2Al+2OH﹣+2H2O=2AlO2+3H2↑
B.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:Cr2O72(橙色)+H2O2CrO42(黄色)+2H+
C.向Na2SiO3溶液中通入过量CO2制备硅酸凝胶:SiO32- +CO2+H2O=H2SiO3(胶体)+ CO32-
D.用Na2CO3溶液浸泡锅炉水垢(含CaSO4):CaSO4+CO32-![]() CaCO3+SO42-
CaCO3+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池总反应为:2Li+ SO2Cl2= 2LiCl+SO2↑。下列叙述中错误的是( )
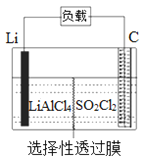
A. 电池工作时负极材料是Li,发生氧化反应
B. 电池工作时电子流向:锂电极→导线→负载→碳棒
C. 电池工作过程中,石墨电极反应式为SO2Cl2+2e-=2Cl-+SO2↑
D. 电池工作时,外电路流过0.2 mol电子,生成2.24 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为满足可穿戴柔性电子设备(如二维手表带状柔性电池)的需求,我国科研团队研制出一种基于有机物电极材料芘四酮(PTO)和锌盐溶液作为电解液组装成的水系锌电池。原理如图所示。下列说法错误的是( )
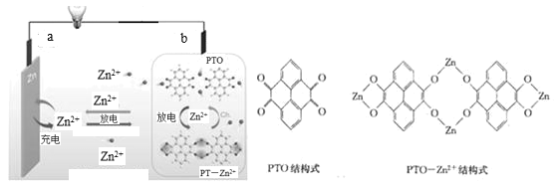
A.充电时,b接外接电源的负极
B.利用以上原理做成的柔性电池除优异的电化学性能外,还具备良好的弯曲性
C.充电时,每生成1molPTO,a电极增重260g
D.放电时,b极的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11,若体积可以加和,则V (Ba(OH)2):V( NaHSO4)为( )
A.1:1B.1:4C.2:1D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是日常生活中的常用调味品。回答下列问题:
(1)五种元素中,原子半径最大的是________,非金属性最强的是________(填元素符号)。
(2)由A分别和B、D、E所形成的共价型化合物中,热稳定性最差的是__________(用化学式表示)。
(3)A、B、E形成的离子化合物电子式为____________,其中存在的化学键类型为____________。
(4)D最高价氧化物的水化物的化学式为________________。
(5)单质D在充足的单质E中燃烧,反应的化学方程式为__________________;D在不充足的E中燃烧,生成的主要产物的化学式为__________。
(6)单质E与水反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国人自古就有泡药酒的习惯。药酒多选用50-60度的白酒,将中药材浸泡在酒中,经过一段时间,中药材中的有效成分(主要是有机物)溶解在酒中,此时即可过滤去渣后饮用。泡药酒的原理属于

A.萃取B.结晶C.干燥D.置换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,填写有关现象及化学方程式。
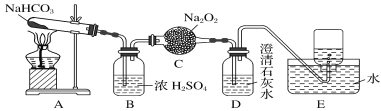
(1) D装置的作用是________,E中收集的气体是___________ (填名称)。
(2) 浓硫酸的作用是 _____________。
(3) A中发生反应的化学方程式为____________。
(4) C中发生反应的化学方程式为_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu,25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:(友情提示:要将溶液中的![]() 、
、![]() 、
、![]() 、
、![]() 沉淀为氢氧化物,需溶液的pH分别为:6.4、6.4、3.7、4.7)
沉淀为氢氧化物,需溶液的pH分别为:6.4、6.4、3.7、4.7)
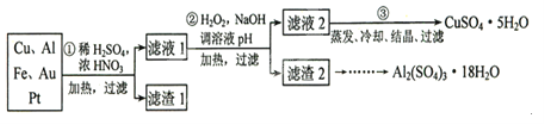
请回答下列问题:
(1)如何检验滤液1中是否含有![]() ?_______________;得到滤渣1的主要成分为____________。
?_______________;得到滤渣1的主要成分为____________。
(2)第2步加![]() 的作用是____________,使用
的作用是____________,使用![]() 的优点是____________;调溶液pH的目的是使____________生成沉淀。
的优点是____________;调溶液pH的目的是使____________生成沉淀。
(3)用第③步所得![]() 制备无水
制备无水![]() 的方法是____________。
的方法是____________。
(4)由滤渣2制取![]() ,探究小组设计了三种方案:
,探究小组设计了三种方案:
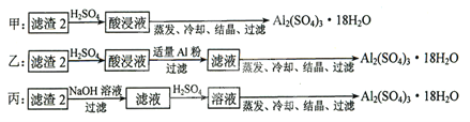
上述三种方案中,______方案不可行,原因是_________;从原子利用率角度考虑,______方案更合理。
(5)结晶水的测定:将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至250℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误:______________、______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com