
| A. | 11:2 | B. | 9:1 | C. | 9:4 | D. | 5:1 |
分析 Cl2生成ClO-与ClO3-是被氧化的过程,Cl2生成NaCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,根据ClO-与ClO3-的物质的量浓度之比可计算失去电子的总物质的量,进而可计算得到电子的总物质的量,求溶液中NaCl与NaClO3的物质的量浓度之比,由此分析解答.
解答 解:因为NaClO与NaClO3的物质的量之比为4:1,设NaClO与NaClO3的物质的量分别为4xmol和xmol,所以失电子的物质的量为4x+5x=9x,根据得失电子守恒则氯化钠的物质的量为9x,在同一溶液中物质的量浓度之比等于物质的量之比,即溶液中NaCl与NaClO3的物质的量浓度之比为9:1,故选B.
点评 本题考查氧化还原反应的计算,题目难度不大,本题注意从氧化还原反应中氧化剂和还原剂之间得失电子数目相等的角度计算,注意守恒法的利用.


科目:高中化学 来源: 题型:实验题
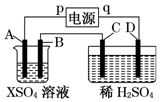 如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
| 阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
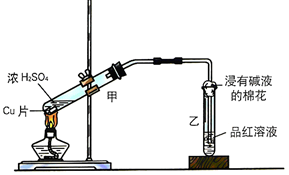
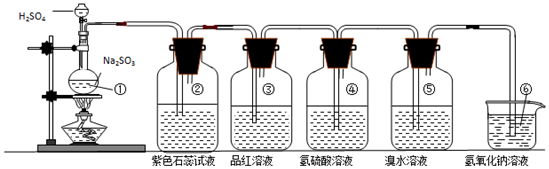
| 装置序号 | 实验现象或作用 | 实验结论或化学方程式 |
| ① | 有气泡产生 | 化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑ |
| ② | 紫色石蕊试液变红色 | 证明SO2溶于水显酸性 |
| ③ | 品红溶液褪色 | 证明SO2具有漂白性 |
| ④ | 溶液变浑浊 | 证明SO2具有氧化性 |
| ⑤ | 溴水褪色 | 证明SO2具有还原性 |
| ⑥ | 吸收尾气 | 证明SO2属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 62g白磷(白磷P4为正四面体结构P原子位于顶点)中含P-P共价键为6NA | |
| B. | 1molCl2全部发生反应时,无论什么时候都是得到的电子数一定为2NA | |
| C. | 若一个CO的质量为a g,则CO的摩尔质量为a NA | |
| D. | 常温下10LpH=13的NaOH溶液中含有的OH-离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
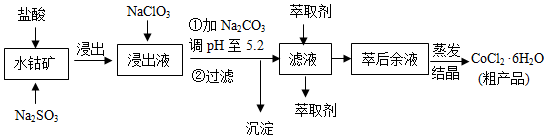
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
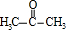 ;A加聚产物的结构简式是
;A加聚产物的结构简式是  .
.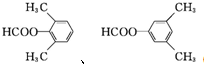 .
.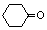 (环已酮)合成
(环已酮)合成 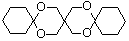 [已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]
[已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]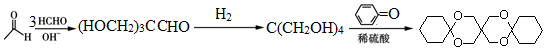 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
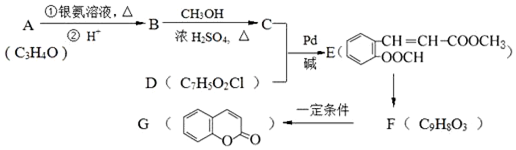

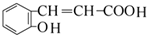 .
.
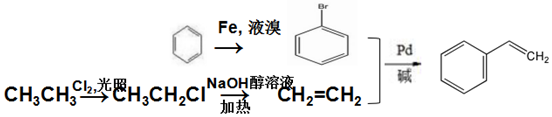 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com