
| 2.24L |
| 22.4L/mol |
| n |
| V |
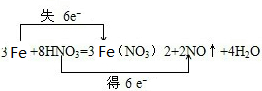 ,
, ;
;| 2.24L |
| 22.4L/mol |
| 3 |
| 2 |
0.1mol×
| ||
| 0.1L |


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰、干冰、水玻璃 |
| B、氮气、氧气、小苏打 |
| C、有液氯、冰水、漂粉精 |
| D、氯气、铁红、胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、O-t1 min的平均反应速率为v(H2)=
| ||
| B、保持其他条件不变,若容器内的压强不改变时,该反应一定达到了化学平衡状态 | ||
| C、保持其他条件不变,若起始时向容器中充入0.60mol CO和1.20mol H2O,则达到平衡时n(CO2)=0.40mol | ||
| D、保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO的转化率增大,CO2的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2和SiO2 |
| B、HCl和AlCl3 |
| C、NaCl和NaOH |
| D、CCl4和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
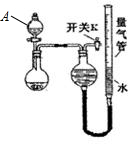
| 编号 | 粉末质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 2.0g | 10.0mL | 346.2mL |
| ② | 2.0g | 10.0mL | 335.0mL |
| ③ | 2.0g | 10.0mL | 345.8mL |

查看答案和解析>>
科目:高中化学 来源: 题型:
 利用图装置进行下列实验,能得出相应实验结论的是( )
利用图装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 浓盐酸 | MnO2 | NaOH溶液 | 制氯气并吸收尾气 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、 氧化性 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸>碳酸 >硅酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com