
研究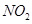 、
、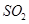 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。
(1)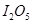 可使
可使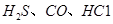 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知:
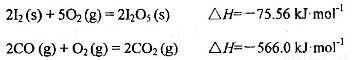
写出CO(g)与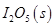 反应生成
反应生成 的热化学方程式:________________。
的热化学方程式:________________。
(2)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,K+移向_______极(填“正”或“负”),正极反应方程式为:___________________。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷
酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料。
①该复合肥料可能的化学式为___________(写出一种即可)。
②若氨水与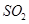 恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
常温下弱电解质的电离平衡常数如下:氨水
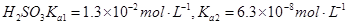
③向②中溶液中通入________气体可使溶液呈中性。(填“SO2”或NH3”)
此时溶液中 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”)
(4)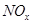 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将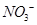 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
(每空2分)
(1)5CO(g) + I2O5(s) = 5CO2 + I2(s) ∆H= -1377.22kJ•mol‾1
(2)正,O2 + 2H2O +4e‾ = 4OH‾
(3)① (NH4)3PO4或(NH4)2HPO4或NH4H2PO4
②碱 ③ SO2 >
(4)3Fe2+ + NO3‾ + 4H+ =3Fe3+ +NO↑+ 2H2O
【解析】
试题分析:(1)先写出化学方程式,标明各物质的状态,然后根据盖斯定律求算∆H,
∆H= —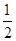 ∆H1 +
∆H1 +  ∆H2,带入相关数据可得答案。
∆H2,带入相关数据可得答案。
(2)原电池电解质溶液中,阳离子移向正极;电解质为KOH溶液,所以正极反应为O2在H2O存在条件下得电子生成OH‾。
(3)①分析反应物,氨气、二氧化硫反应后再与磷酸反应,由磷酸的量不同可生成(NH4)3PO4或(NH4)2HPO4或NH4H2PO4。
②氨水与SO2恰好完全反应生成(NH4)2SO3,水解显碱性。
③因为②中溶液显碱性,所以通入SO2可中和OH‾,使溶液显中性;根据电荷守恒可知:[NH4+]+[H+]=[OH‾]+2[SO32‾]+[HSO3‾],溶液中性[H+]=[OH‾],得[NH4+]=2[SO32‾]+[HSO3‾],所以[NH4+]/[SO32‾]>2。
(4)根据信息找出反应物和生成物,配平可得离子方程式。
考点:本题考查热化学方程式的书写、原电池原理、盐类的水解、离子浓度比较和离子方程式的书写。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源:2012届山东省潍坊市三县市高三上学期期中联合考试化学试卷 题型:填空题
(10分)研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。
已知:①CO(g)+ 1/2O2(g)=CO2(g) △H=-283.0KJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296.0KJ·mol-1
此反应的热化学方程式是 。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
① CO(g)+NO2(g)=NO(g)+CO2(g) △H=-aKJ·mol-1 (a>0)
② 2CO(g)+2NO (g)=N2(g)+2CO2(g) △H=-bKJ·mol-1 (b>0)
若用标准状况下 3.36LCO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 KJ(用含有a和b的代数式表示)。
(3)用CH4催 化还原NOx也可以消除氮氧化物的污染。例如:
化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574KJ·mol-1 ①
②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g) △H2=?②
若1molCH4还原NO2至N2整个过程中放出的热量为867KJ,则△H2= 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三上学期期末考试化学试卷(解析版) 题型:填空题
)2013年全国各地连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害,因此研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.脱硫技术能有效控制SO2对空气的污染。
(1)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、CI-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:

①向曝气池中通入空气的目的是 ???????????????????????
②通入空气后曝气池中海水与天然海水相比,浓度没有明显变化的离子是??? 。
a.Cl-? B.SO42-? C.HCO3-
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)

①图中b极要连接电的(填“正”或“负”) ?? 极,C口流出的物质是? ?????? 。
②SO32-放电的电极反应式为???????????????????????? ??
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 ?? ? 。
II.我国的能消费结构以燃煤为主,将煤气化可减少环境污染,但煤气化过程中能产生有害气体H2S,用足量的Na2CO3溶液可吸收,该反应的离子方程式为 ? 。
(已知:H2S Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3? Kal=4.30×10-7;Ka2=5.61 ×10-11)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省渭南市高三第二次模拟理综化学试卷(解析版) 题型:计算题
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)下图是在101kPa,298k条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中能量变化示意图。

已知:① N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
② 2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
则在298k时,反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=
。
N2(g)+2CO2(g)的△H=
。
(2)将0.20mol NO2和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。

①下列说法正确的是 。(填序号)
a.容器内的压强不发生变化说明该反应达到平衡
b.当向容器中加再充入0.20mol NO时,平衡向正反应方向移动,K值增大
c.升高温度后,K值减小,NO2的转化率减小
d.向该容器内充入He气,反应物的体积减小,浓度增大,所以反应反应速率增大
②计算产物NO在0~2min时平均反应速率v(NO)= mol·L-1·min-1;
③第4min时改变的反应条件为 (填“升温”、“降温”);
④计算反应在第6min时的平衡常数K= 。若保持温度不变,此时再向容器中充入CO、NO各0.060mol,平衡将 移动(填“正向”、“逆向”或“不”)。
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极的反应式为 ,当有0.25molSO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 。

(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSP=2.8×10-9mol2/L2。现将2×10-4mol/L的Na2CO3溶液与一定浓度的CaC12溶液等体积混合生成沉淀,计算应加入CaC12溶液的最小浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com