
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 6:3:2 |
分析 n(硫酸)=0.1L×0.5mol/L=0.05mol,则n(H+)=0.05mol×2=0.1mol,Na、Mg、Al三种金属各0.3mol,可知金属均过量,以此来解答.
解答 解:n(硫酸)=0.1L×0.5mol/L=0.05mol,则n(H+)=0.05mol×2=0.1mol,H得到电子为0.1mol,
Na、Mg、Al三种金属各0.3mol,若完全反应,失去电子分别为0.3mol、0.6mol、0.9mol,
可知金属均过量,酸不足,酸完全反应,则生成氢气相同,在标准状况下生成的氢气的体积比是1:1:1,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握物质的量计算、电子守恒为解答的关键,侧重分析与计算能力的考查,注意过量判断,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 任何条件下,等物质的量 的水和一氧化碳所含有的分子数必相等 | |
| B. | 同温同压下,相同体积的物质,它们的物质的量必相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 1mol任何气体所占的体积都约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间独特的键 | |
| B. | 将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应 | |
| C. | 乙烷和丙烯的物质的最共1mol,完全燃烧后生成3molH2O | |
| D. | 主链上有5个碳原子的庚烷有5 种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③ | C. | ①③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
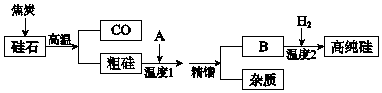
| 物质 | SiCl4 | SiHCl3 | FeCl3 | AlCl3 |
| 熔点/℃ | -70 | -128.2 | 306 | -- |
| 沸点/℃ | 57.6 | 31.85 | 315 | 181 升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 4:2:1 | C. | 2:3:4 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做电解池的阴极,和外加电源的负极相连 | |
| B. | 做电解池的阴极,和外加电源的正极相连 | |
| C. | 做电解池的阳极,和外加电源的负极相连 | |
| D. | 做电解池的阳极,和外加电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com