
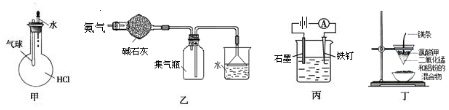
| A. | 如图装置甲:验证HCl气体在水中的溶解度大 | |
| B. | 如图装置乙:可干燥、收集氨气,并吸收多余的氨 | |
| C. | 如图装置丙:防止铁钉生锈 | |
| D. | 如图装置:可制得金属锰 |
分析 A.滴入水后圆底烧瓶中压强减小,根据气球变化可证明HCl的溶解度大小;
B.氨气的密度小于空气,为碱性气体,极易溶于水,据此判断氨气的干燥、收集和吸收方法;
C.铁与电源正极相连,为电解池的阳极,无法防止铁钉生锈;
D.通过铝热反应可以得到金属锰.
解答 解:A.图示装置中滴入水后气球迅速增大,可验证HCl气体在水中的溶解度大,故A不选;
B.氨气为碱性气体,可以用碱石灰干燥,氨气密度小于空气,可以用向下排空气法收集,氨气极易溶于水,吸收多余氨气时需要防止倒吸,图示装置合理,能够达到实验目的,故B不选;
C.该装置中Fe为阳极,工作时Fe优先放电,无法达到实验目的,故C选;
D.图示装置为铝热反应,可通过该反应获得锰,故D不选;
故选C.
点评 本题考查化学实验方案的评价,题目难度不大,涉及气体制取、干燥与收集、铝热反应、电解原理等知识,明确电解原理、铝热反应原理为解答关键,试题培养了学生的分析能力及化学实验能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯与钠形成离子键,氯与硅形成共价键 | |
| B. | 向淀粉KI溶液中滴加溴水,溶液变蓝 | |
| C. | 向Na2SO3溶液中滴加盐酸,有气泡生成 | |
| D. | F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: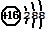 | |
| B. | 过氧化氢的电子式: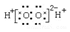 | |
| C. | Ge原子的简化电子排布式:[Ar]4s24p2 | |
| D. | 氯化钠的分子式:NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英是制造光导纤维的原料,也是常用的半导体材料 | |
| B. | 氧化铝是冶炼金属铝的原料,也是较好的耐火材料 | |
| C. | 天然氨基酸能溶于强碱或强酸溶液,是两性化合物 | |
| D. | 船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
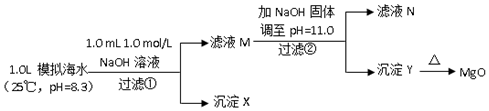
| 模拟海水中的离子浓度/ (mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
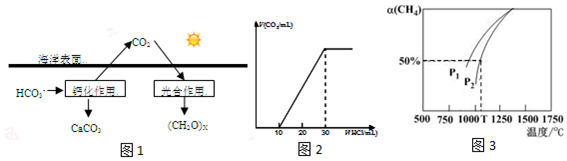
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
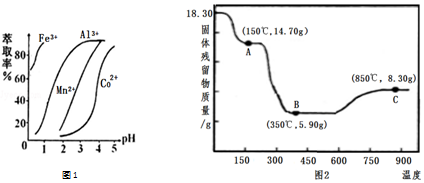
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若开始时开关K与a连接,其反应与铁的吸氧腐蚀类似 | |
| B. | 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol | |
| C. | 若开始时开关K与b连接,则该装置是化学能转变为电能 | |
| D. | 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com