
| A. | 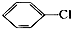 | B. | CH3CH2CH2Br | ||
| C. | 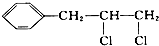 | D. | 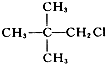 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
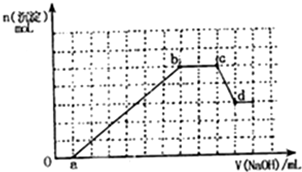 某无色溶液中可能含有H+,NH4+,Mg2+,Fe3+,Al3+,SO42-,HCO3-等离子,当向溶液中加入一定浓度NaOH溶液,生成沉淀物质的量随加入NaOH溶液体积关系如图所示.
某无色溶液中可能含有H+,NH4+,Mg2+,Fe3+,Al3+,SO42-,HCO3-等离子,当向溶液中加入一定浓度NaOH溶液,生成沉淀物质的量随加入NaOH溶液体积关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 常温下将Al片放入浓硝酸中无明显变化 | Al与浓硝酸不反应 |
| B | 加热滴有酚酞的醋酸钠溶液,溶液红色变深 | 加热促进CH3COO-水解,溶液的碱性增强 |
| C | 将溴水分别滴入植物油和裂化汽油中,溴水均褪色 | 前者由于萃取而褪色,后者由于发生加成反应而褪色 |
| D | 加热NaHCO3溶液无明显变化 | NaHCO3的热稳定性强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
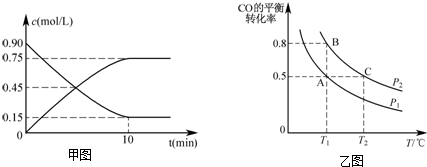
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由溴乙烷制乙烯;由石油制乙烯 | |
| B. | 由乙烯制乙烷;由乙醇制乙醛 | |
| C. | 乙烯使溴水褪色;甲苯使酸性KMnO4溶液褪色 | |
| D. | 由硝酸与苯反应制硝基苯;甲烷与Cl2光照 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
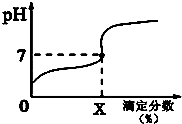 常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是( )
常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是( )| A. | HA溶液加水稀释后,溶液中$\frac{c(HA)}{c({A}^{-})}$的值减小 | |
| B. | HA的电离常数KHA=$\frac{1{0}^{-7}X}{100-X}$(x为滴定分数) | |
| C. | 当滴定分数为100时,溶液中水的电离程度最大 | |
| D. | 滴定分数大于100时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 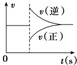 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 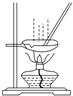 用图所示装置蒸发AlCl3溶液制备无水AlCl3 用图所示装置蒸发AlCl3溶液制备无水AlCl3 | |
| C. | 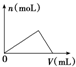 图可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 图可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 | |
| D. | 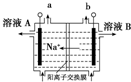 图电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B 图电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+ | B. | Na+、Al3+、Mg2+ | C. | Na+、Mg2+、[Al(OH)4]- | D. | Na+、[Al(OH)4]- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com