
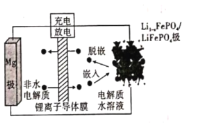
【题目】Mg-LiFePO4电池的电池反应为![]() ,其装置示意图如下:(锂离子导体膜只允许Li+通过)。下列说法正确的是
,其装置示意图如下:(锂离子导体膜只允许Li+通过)。下列说法正确的是
A.放电时,Li+被还原
B.放电时,电路中每流过2 mol电子,有1 mol Mg2+迁移至正极区
C.充电时,阳极上发生的电极反应为:![]()
D.充电时,导线上通过1 mol电子,左室溶液质量减轻12 g
【答案】C
【解析】
由总反应式可知,放电时为原电池反应,Mg化合价升高,被氧化,Mg作负极,电极反应式为Mg2e=Mg2+,则Li1xFePO4被还原,作原电池正极,电极反应式为Li1xFePO4+xLi++e=LiFePO4,阳极反应和原电池正极相反,发生氧化反应,据此分析解答。
由总反应式可知,放电时为原电池反应,Mg化合价升高,被氧化,Mg作负极,电极反应式为Mg2e=Mg2+,则Li1xFePO4被还原,作原电池正极,电极反应式为Li1xFePO4+xLi++e=LiFePO4,阳极反应和原电池正极相反,发生氧化反应,
A. 放电时,锂离子化合价未发生变化,A项错误;
B. 电池中间是锂离子导体膜,所以镁离子不能通过,B项错误;
C. 放电时,正极反应式为Li1xFePO4+xLi++e=LiFePO4,则充电时,阳极上电极反应为: ![]() ,C项正确;
,C项正确;
D. 充电时,左室阴极发生反应Mg2++2e=Mg,右室阳极发生反应![]() ,当导线上通过1 mol电子时,左室0.5mol Mg2+析出生成镁单质,同时会有1mol Li+离子移动向左室,则左室溶液质量减轻12-7=5 g,D项错误;
,当导线上通过1 mol电子时,左室0.5mol Mg2+析出生成镁单质,同时会有1mol Li+离子移动向左室,则左室溶液质量减轻12-7=5 g,D项错误;
答案选C。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g) H<0,下列研究目的和图示相符的是( )
A.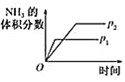 压强对反应的影响
压强对反应的影响
B.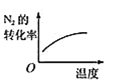 温度对反应的影响
温度对反应的影响
C.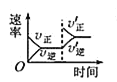 平衡体系增加N2对反应的影响
平衡体系增加N2对反应的影响
D.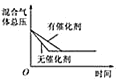 催化剂对反应的影响
催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究乙醇和金属钠反应生成![]() 的原理,某同学做了如下四个实验。
的原理,某同学做了如下四个实验。
甲:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体
乙:设法检验甲收集到的气体。
丙:向试管中加人![]() 水,并加入绿豆粒大小的金属钠,观察现象。
水,并加入绿豆粒大小的金属钠,观察现象。
丁:向试管中加人![]() 乙醚(
乙醚(![]() ),并加入绿豆粒大小的金属钠,发现无明显变化。
),并加入绿豆粒大小的金属钠,发现无明显变化。
回答以下问题:
(1)从结构上分析,该实验选取水和乙醚作参照物的原因是__________。
(2)丙的目的是证明_____________;丁的目的是证明_______;根据丙和丁的结果,可以得出乙醇和金属钠反应的化学方程式应为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)= 2H2O(g)△H=-483.6kJ/mol
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________;
(2)向1L密闭容器中加入2mol CO、4mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)![]() CH3OCH3(l)+H2O(l)△H=+71kJ/mol
CH3OCH3(l)+H2O(l)△H=+71kJ/mol
①该反应能否_________自发进行(填“能”、“不能”或“无法判断”)
②下列叙述能说明此反应达到平衡状态的是_________.
a.混合气体的平均相对分子质量保持不变
b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变
d.混合气体的密度保持不变
e.1mol CO生成的同时有1mol O-H键断裂
(3)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
恒温 恒容 (T1℃、 2L) | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 |
①0~10min内,用H2O(g)表示的化学反应速率v(H20)=_________mol/(L·min)
②达到平衡时,该反应的平衡常数K=_________(用分数表示),平衡时H2的转化率是_________。
③在其它条件不变的情况下,若30min时改变温度为T
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式正确的是
A.已知H2的标准燃烧热ΔH=-285.8 kJ·mol-1,则用热化学方程式可表示为:H2(g)+1/2O2(g)===H2O(g)ΔH=-285.8 kJ·mol-1
B.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O===Fe(OH)2↓+2HClO
C.NH4HSO3溶液与足量NaOH溶液共热:NH4++H++2OH-![]() NH3↑+2H2O
NH3↑+2H2O
D.用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O===2Mn2++5SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
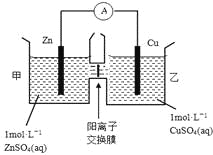
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态O原子核外电子排布式为_______,基态P原子核外占据最高能级的电子云轮廓图为_________形;

(2)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为___________,每个P4S3分子中含孤电子对的数目为_______。
(3)Na、O、S简单离子半径由大到小的顺序为__________
(4)SO2易溶于水,在水中的溶解度为1体积的水溶解40体积的SO2,原因是________。
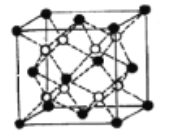
(5)Li2O的晶胞如图所示(其中白球代表Li,黑球代表O)。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com