
 ȼ�ϵ�ʹ�úͷ���Ⱦ����ᷢչ��һ�����رܵ�ì�ܻ��⣮
ȼ�ϵ�ʹ�úͷ���Ⱦ����ᷢչ��һ�����رܵ�ì�ܻ��⣮���� ��1����CH4��g��+2NO2��g���TN2��g��+CO2��g��+2H2O��g����H1=-860.0kJ•mol-1
��2NO2��g��?N2O4��g����H2=-66.9kJ•mol-1
������ʽ��-�ڵü��黹ԭN2O4ΪN2���Ȼ�ѧ����ʽ��
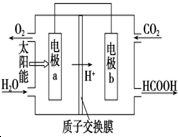
��2�����������ӵ��ƶ������ж���������b�缫�϶�����̼�õ������ɼ��
��3����״����2.24LCO2�����ʵ���Ϊ0.1L��1.5mol/LNaOH��Һ�к���0.15molNaOH������ǡ�÷�����Ӧ2CO2+3NaOH=Na2CO3+NaHCO3+H2O����Ӧ�������˵�Ũ�ȵ�̼���ƺ�̼�����ƣ�Ȼ�����ε�ˮ��ԭ���жϸ�����Ũ�ȴ�С��
��4����̼������������������Ӧ��������ƺͶ�����̼��
��Na2CO3��Һ��Ũ��Ϊ1��10-4mol/L���������Ϻ���Һ��c��CO32-��=5.0��10-5mol/L������Ksp=c��CO32-��•c��Ca2+���������ʱ�����Һ��c��Ca2+����ԭ��ҺCaCl2��Һ����СŨ��Ϊ�����Һ��c��Ca2+����2����
��� �⣺��1����CH4��g��+2NO2��g���TN2��g��+CO2��g��+2H2O��g����H1=-860.0kJ•mol-1
��2NO2��g��?N2O4��g����H2=-66.9kJ•mol-1
���ݸ�˹���ɽ�����ʽ��-�ڵü��黹ԭN2O4ΪN2���Ȼ�ѧ����ʽCH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��g����H=-793.1 kJ/mol��
�ʴ�Ϊ��CH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��g����H=-793.1 kJ/mol��
������ʽ��-�ڵü��黹ԭN2O4ΪN2���Ȼ�ѧ����ʽ��
��2��ԭ��ع���ʱ���������������ƶ���ͼ����������b���ƶ�������bΪ������aΪ������b�缫�϶�����̼�õ������ɼ��ᣬ��缫����ʽΪ��CO2+2H++2e-=HCOOH��
�ʴ�Ϊ������CO2+2H++2e-=HCOOH��
��3����״���£�2.24LCO2�����ʵ���Ϊ��$\frac{2.24L}{22.4L/mol}$=0.1mol��
100mL 1.5mol/LNaOH��Һ�к���0.15molNaOH�����߷�����Ӧ2CO2+3NaOH=Na2CO3+NaHCO3+H2O���ɵ�Ũ�ȵ�Na2CO3��NaHCO3��HCO3-��CO32-����ˮ�⣬��Һ�ʼ��ԣ���c��OH-����c��H+��������CO32-ˮ��̶ȴ���HCO3-����c��HCO3-����c��CO32-����
���Է�Ӧ����Һ�е�����Ũ�ȴ�СΪ��c��Na+����c��HCO3-����c��CO32-����c��OH-����c��H+����
�ʴ�Ϊ��c��Na+����c��HCO3-����c��CO32-����c��OH-����c��H+����
��4����ʯ��ʯ-ʯ��ʪ�����������ռ����Ĺ���ԭ���������еĶ��������뽬Һ�е�̼��Ƽ�����Ŀ�����Ӧ����ʯ�ࣨCaSO4•2H2O������̼������������������Ӧ��������ƺͶ�����̼���䷴Ӧ�ķ���ʽΪ��2CaCO3+2SO2+O2+4H2O�T2��CaSO4•2H2O��+2CO2��
�ʴ�Ϊ��2CaCO3+2SO2+O2+4H2O�T2��CaSO4•2H2O��+2CO2��
��Na2CO3��Һ��Ũ��Ϊ2��10-4mol/L���������Ϻ���Һ��c��CO32-��=1��10-4mol/L������Ksp=c��CO32-��•c��Ca2+��=2.8��10-9��֪��c��Ca2+��=$\frac{2.8��1{0}^{-9}}{1��1{0}^{-4}}$mol/L=2.8��10-5mol/L��ԭ��ҺCaCl2��Һ����СŨ��Ϊ�����Һ��c��Ca2+����2������ԭ��ҺCaCl2��Һ����СŨ��Ϊ5.6��10-5mol/L��
�ʴ�Ϊ��5.6��10-5mo1/L��
���� ���⿼���˸�˹���ɵ�Ӧ�ú��Ȼ�ѧ����ʽ��ԭ���ԭ����Ӧ�á���ѧ��Ӧ������Ũ�ȴ�С�Ƚϡ�Ksp���йؼ���ȣ���Ŀ�ۺ��Խϴ��Ѷ��еȣ��Ƕ�֪ʶ���ۺ����á�ע�����֪ʶ���������գ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ŵ�ʱPb��Ϊ���� | |
| B�� | ���ʱ�����ϱ��С�+���ŵ缫���ӵ�Դ���� | |
| C�� | �ŵ�ʱ������ӦΪPbO2+SO42-+4H++2e�TPbSO4+2H2O | |
| D�� | ���ʱ�����ϱ��С�-���ŵĵ缫����������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ħ����һ�������� | |
| B�� | ��Һ�л�����״̬���ܵ�������ʾ��ǵ���� | |
| C�� | ������ԭ��Ӧ�ı�����Ԫ�ػ��ϼ۷����˱仯 | |
| D�� | �õ��ӵ����ʱ���ԭ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
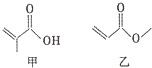
| A�� | �ס��һ�Ϊͬ���칹�� | |
| B�� | �ס��Ҷ�������ĵ��ʷ����ӳɷ�Ӧ | |
| C�� | һ�������£��ס��Ҿ��ܷ���ȡ����Ӧ | |
| D�� | �ס��Ҷ���������Ʒ�Ӧ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������PM2.5�ȱ������������ǿ�������������ж��к����� | |
| B�� | �ڳ����������������ӵ�ʳ���еĵ� | |
| C�� | 14C��������������ļ�����14C��12C��Ϊͬλ�� | |
| D�� | �Ȳ�����ʱ���ӷ�ά����CЧ�����ã�ԭ����ά����C���л�ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ�������£�1molN2��3molH2��ַ�Ӧ���������е�N-H����ĿΪ6NA | |
| B�� | 9.2g ��NO2��N2O4��ɵĻ�����к�����ԭ�ӵ���ĿΪ 0.2NA | |
| C�� | ��ȫȼ��1.5molCH3CH2OH��C2H4�Ļ���ת�Ƶ�����Ϊ18NA | |
| D�� | 1L 0.1 mol•L-l��Na2S��Һ��S2-��HS-������Ϊ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
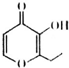 �׳ơ�һ���㡱�����ʱ���ʳ�ú�����˸��࣬�����°�����һ���㡱�ķ��ӽṹ��ͼ��ʾ������˵����ȷ���ǣ�������
�׳ơ�һ���㡱�����ʱ���ʳ�ú�����˸��࣬�����°�����һ���㡱�ķ��ӽṹ��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ���л���ķ���ʽΪC8H8O3 | |
| B�� | 1 mo1���л���������� 2 mol H2�����ӳɷ�Ӧ | |
| C�� | ���л����ܷ���ȡ�����ӳɺ�������Ӧ | |
| D�� | ���л�������̼�����Ʒ�Ӧ����CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Һ�д�������ƽ�⡢�������� | |
| B�� | ����Һ��K+��NH4+��NO3-��Al3+���Դ������� | |
| C�� | �μ�����ϡ���ᣬ����������� | |
| D�� | ͨ������SO2���壬������Ӧ�����ӷ���ʽ��2S2-+SO2+2H2O�T3S��+4OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 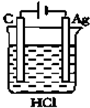 | B�� | 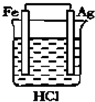 | C�� | 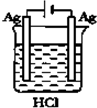 | D�� | 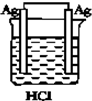 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com