
| 装 置 | 现 象 |
 |
ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 ⅲ.试管变热,溶液沸腾 |
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
| 装 置 | 现 象 |
 |
ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,有刺激性气味 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、在pH=0的溶液中:Cl-、Na+、K+、C6H5-O-(C6H5一为苯基) |
| B、加入铝屑有氢气放出的溶液中:NH4+、K+、HCO3-、Br- |
| C、在H2SO3溶液中:HSO3-、K+、Cl-、Ba2+ |
| D、在葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol?L-1 Na2CO3溶液中,含CO32-数目小于NA |
| B、标准状况下,11.2L O2和O3组成的混合气体含有原子数为NA |
| C、14 g聚乙烯与聚丙烯的混合物,含C-H键的数目为2NA |
| D、常温常压下,22.4L CO2与足量Na2O2反应转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石英只能用于生产光导纤维 |
| B、从海水提取物质都必须通过化学反应才能实现 |
| C、为了增加食物的营养成分,可以大量使用食品添加剂 |
| D、淀粉、纤维素和脂肪在一定条件下都可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应A2(g)+3B2(g)═2AB3(g)在一定温度下能自发进行,则该反应的△H<0 |
| B、将NH3 通入热的CuSO4 溶液中能使Cu2+还原成Cu |
| C、钙和镁的氯化物溶液蒸发结晶出来的固体都是水合物,经焙烧得相应无水盐 |
| D、用酸溶解金属铝时,溶解的速率与铝的纯度有关,纯度越高速率越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
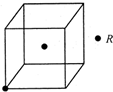 现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5.
现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5.查看答案和解析>>
科目:高中化学 来源: 题型:
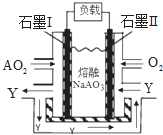 A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:| 元素 | A | B | C | D | E |
| 相关 信息 |
最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |
查看答案和解析>>
科目:高中化学 来源: 题型:
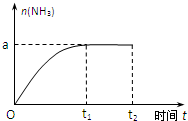 已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.
已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量氯气通入溴化亚铁溶液中:2Cl2+2Fe2++2Br-═4Cl-+2Fe3++Br2 |
B、向苯酚溶液中滴加Na2CO3溶液: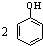 +CO32-→ +CO32-→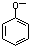 +CO2↑+H2O +CO2↑+H2O |
| C、足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
| D、用过量的冷氨水吸收SO2:SO2+2NH3?H2O═SO32-+2NH4++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com