
| A. | 未冷却就转移、定容 | B. | 容量瓶原有少量蒸馏水 | ||
| C. | 定容时俯视刻度线观察液面 | D. | 量筒取浓盐酸时,俯视读数 |
分析 分析操作对溶质的物质和量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使n偏小或者使V偏大的操作都能是溶液浓度偏低,反之溶液浓度增大,
解答 解:A.未冷却就转移、定容,冷却后,液面下降溶液体积偏小,溶液浓度偏高,故A不选;
B.容量瓶原有少量蒸馏水,对溶质的物质的量和溶液体积的都不会产生影响,溶液浓度不变,故B不选;
C.定容时俯视刻度线观察液面,导致溶液体积偏大,溶液浓度偏低,故C选;
D量筒取浓硫酸时,俯视读数导致量取体积偏大,溶质物质的量偏大,溶液浓度偏高,故D不选;
故选:C.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意分析操作对溶质的物质和量和溶液体积的影响,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 某无色气体通入澄清石灰水中 | 生成白色沉淀 | 该气体一定是CO2 |
| B | 常温下铜片插入浓硫酸中 | 无明显现象 | 常温下铜遇浓硫酸钝化 |
| C | 用洁净的铁丝蘸取某溶液进行焰色反应实验 | 火焰呈黄色 | 该溶液含有Na+,一定不含K+ |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
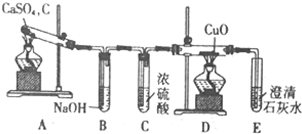
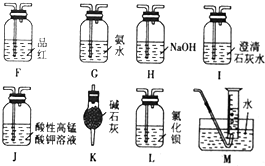
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始瞬间HCl、H2SO4、CH3COOH反应速率相等 | |
| B. | 至反应结束时CH3COOH中放出H2的总量最多 | |
| C. | 收集相同体积的H2的CH3COOH所用时间最长 | |
| D. | 至反应结束时HCl、H2SO4收集到H2的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性能将Fe氧化成Fe3+ |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| D | 向某溶液中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com