
【题目】次硫酸钠甲醛(xNaHSO2yHCHOzH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:①准确称取1.5400g样品,完全溶于水配成100mL溶液。②取25.00mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10mol×L-1。③另取25.00mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.5825g。次硫酸氢钠和碘反应的方程式如下:xNaHSO2yHCHOzH2O+I2→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.5825g白色固体时,需要消耗碘的质量为_____。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式_____。
(3)通过计算确定次硫酸氢钠甲醛的组成______(写出计算过程)。
【答案】1.27g 2HCHO+OH-=CH3OH+HCOO- NaHSO2·HCHO·2H2O
【解析】
(1)根据次硫酸氢钠甲醛和碘单质之间反应的化学反应方程式来计算即可;
(2)甲醛会发生自身氧化还原反应,被氧化为甲酸,被还原为甲醇;
(3)根据元素守恒结合物质之间的反应情况来计算。
(1)根据反应:xNaHSO2yHCHOzH2O+I2→NaHSO4+HI+HCHO+H2O,据电子守恒,生成1mol的NaHSO4,消耗碘单质2mol,硫酸根守恒,得到白色固体0.5825g,即生成硫酸钡的质量是0.5825g,物质的量是![]() =0.0025mol,消耗碘单质的质量是:0.005mol×254g/mol=1.27g,故答案为:1.27g;
=0.0025mol,消耗碘单质的质量是:0.005mol×254g/mol=1.27g,故答案为:1.27g;
(2)甲醛会发生自身氧化还原反应,被氧化为甲酸,被还原为甲醇,该反应的离子方程式为:2HCHO+OH-=CH3OH+HCOO-,故答案为:2HCHO+OH-=CH3OH+HCOO-;
(3)25.00mL溶液中:
n(NaHSO2) =n(NaHSO4) =n( BaSO4)=0.5825g/233g·mol-1=0.0025mol
n(HCHO) =0.0025mol
100 mL 溶液中:
n(NaHSO2)=4×0.0025 mol=0.01mol
n(HCHO)=4×0.0025 mol=0.01mol
n(H2O)=(1.5400g-88g·mol-1×0.01mol-30g·mol-1×0.01mol)/18g·mol-1=0.02mol
x:y:z=n(NaHSO2):n(HCHO) :n(H2O)=0.01: 0.01: 0.02 = 1:1:2
次硫酸氢钠甲醛的化学式为:NaHSO2·HCHO·2H2O。


科目:高中化学 来源: 题型:
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )

A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
⑴工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品,_____,搅拌。
②_____。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤。
④将滤液用硝酸调节pH=2~3,_____,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
⑵Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数_________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+![]() O2(g)=4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
O2(g)=4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
②C4H10(g)+![]() O2(g)=4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
O2(g)=4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
③C4H10(g)+![]() O2(g)=4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
O2(g)=4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
④C4H10(g)+![]() O2(g)=4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
O2(g)=4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
由此判断,正丁烷的燃烧热是 ( )
A.ΔH=-1 746kJ·mol-1B.ΔH=-2 658 kJ·mol-1
C.ΔH=-2 878 kJ·mol-1D.ΔH=-1 526 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)2SO3(g) ΔH<0某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:

(1)将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于 ______________________。(不需要写表达式)
(2)平衡状态由A变到B时,平衡常数K(A)___________ K(B)(填“>”、“<”或“=”)。
(3)此反应在恒温密闭的装置中进行,能充分说明此反应已达到平衡的标志是______。
A.接触室中气体的平均相对分子质量不再改变
B.接触室中SO2、O2、SO3的浓度相同
C.接触室中SO2、O2、SO3的物质的量之比为2∶1∶2
D.接触室中压强不随时间变化而变化
(II)已知工业制氢气的反应为CO(g)+H2O(g) CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
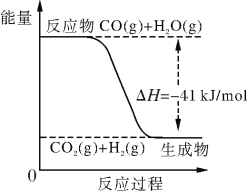
(4)增加H2O(g)的浓度,CO的转化率将________(填“增大”、“减小”或“不变”)。
(5)平衡常数的表达式K=_______。400 ℃时平衡常数K________9(填“>”、“<” 或“=”)。
(6)已知2H2(g)+O2(g) 2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子构型为3s23p4的粒子描述正确的是( )
A.它的原子核外有三种形状不同的电子云
B.它的原子核外电子共有16种不同的运动状态
C.它可与H2反应生成的化合物为非极性分子
D.核外电子轨道表示式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物。请回答下列问题:
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于___区。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti2+中电子占据的最高能层符号为___,该能层具有的原子轨道数为___,BH4-的空间构型是___。
(3)在Cu的催化作用下,乙醇可被空气中氧气氧化为乙醛,乙醛分子中碳原子的杂化方式是___,乙醛分子中HCO的键角___乙醇分子中H-C-O的键角(填“大于”、“等于”或“小于”)。
(4)电镀厂排放的废水中常含有剧毒的CN-,可在TiO2的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为___。
②与CN-互为等电子体微粒的化学式为___(写出一种即可)。
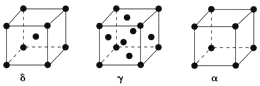
(5)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为___,δ、γ、α三种晶胞的边长之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽水是CO2的饱和溶液,其中存在如下平衡:
H2CO3![]() H++HCO3-……① HCO3-
H++HCO3-……① HCO3-![]() H++CO32-……②
H++CO32-……②
将汽水倒入试管中分别进行下列实验,相应分析结论错误的是
A.加热、平衡①、②可能都向左移动
B.加入澄清石灰水,平衡①、②均向右移动
C.加入CaCO3悬浊液,CaCO3的溶解平衡向正方向移动
D.通入过量CO2或滴加氯水,溶液pH均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com