
【题目】某温度下,体积均为2L的恒容密闭容器Ⅰ和Ⅱ,向Ⅰ中加入1molCO和2mol![]() ,向Ⅱ中加入2molCO和4mol
,向Ⅱ中加入2molCO和4mol![]() ,均发生下列反应并建立平衡:
,均发生下列反应并建立平衡:![]()
![]() 。测得不同温度下CO平衡转化率如图所示,下列说法正确的是
。测得不同温度下CO平衡转化率如图所示,下列说法正确的是![]()

A.根据题干中信息,可推断该反应的![]()
B.反应中L、M两点容器内压强:![]()
C.可以计算出该反应处于N点时,化学平衡常数约为![]()
D.向N点平衡体系中再加入1mol![]() ,新平衡时氢气的增加量小于
,新平衡时氢气的增加量小于![]() mol
mol
【答案】C
【解析】
A、升高温度一氧化碳的转化率减小,说明平衡逆向移动,正反应是放热反应,所以△H<0,故A错误;
B、Ⅰ中加入1molCO和2molH2,向Ⅱ中加入2molCO和4mol H2,如果温度相同,压强P(M)=2P(L),而M点的温度高于L点,所以P(M)>2P(L),故B错误;
C、MN点温度相同,计算M点平衡常数得到N点的平衡常数,一氧化碳的转化率为0.6,
![]()
![]()
初起(mol/L):1 2 0
变化(mol/L):0.6 1.2 0.6
平衡(mol/L):0.4 0.8 0.6
所以平衡常数为:0.6÷(0.4×0.82)=2.34,故C正确;
D、N点平衡体系中再加入1molCH3OH,相当于Ⅰ中再加入1molmolCO和2mol H2,最后达到平衡状态和向Ⅱ中加入2molCO和4mol H2的平衡状态相同,甲醇最后平衡状态为1.2mol,CO转化率60%,则相当于逆向进行甲醇分解率为40%,加入1mol甲醇增大压强平衡正向进行,则分解率小于40%,分解的甲醇小于0.4mol,故D错误;
故选:C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铁系元素是人体必需的微量元素,Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为_____________(任写一种)。
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。


(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________


(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;晶胞的体积是2acm3,镁单质的密度为ρg·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.1 mol 冰中拥有2 mol氢键
B.分子晶体中既有范德华力,又有共价键
C.干冰晶体中,每个CO2分子周围最近且距离相等的CO2分子共有12个
D.晶体熔点:晶体硅<SiC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:

请回答下列问题:
⑴由B2O3制备BN的化学方程式是_______。
⑵基态B原子的电子排布式为_____;B和N相比,电负性较大的是_____,BN中B元素的化合价为_____。
⑶在BF3分子中,F-B-F的键角是_____,B原子的杂化轨道类型为_____,BF3和过量NaF作用可生成NaBF4,![]() 的立体构型为_____。
的立体构型为_____。
⑷氮化硼晶体有多种结构,如立方氮化硼和六方氮化硼等。立方氮化硼结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,则立方氮化硼的密度是______________g·cm-3(只要求列算式,不必计算出数值。阿伏加德罗常数为NA mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温下,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)反应开始至2min,以气体Z表示的平均反应速率为___;
(2)达平衡时X与Y的转化率之比为__;
(3)反应达到平衡时:压强是开始时的__倍;
(4)若此时将容器的体积缩小为原来的![]() 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为__(填“放热”或“吸热”)反应。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为__(填“放热”或“吸热”)反应。
(5)达平衡时该反应放出9.2kJ的热量,则该反应的热化学方程式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如![]() 溶液常用作电解液、电镀液等.请回答以下问题:
溶液常用作电解液、电镀液等.请回答以下问题:
![]() 亚铜离子
亚铜离子![]() 基态时的核外电子排布式为 ______
基态时的核外电子排布式为 ______
![]() 晶体的堆积方式是 ______ ,其配位数为 ______ ;
晶体的堆积方式是 ______ ,其配位数为 ______ ;
![]() 往硫酸铜溶液中加入过量氨水,可生成
往硫酸铜溶液中加入过量氨水,可生成![]() ,下列说法正确的是 ______
,下列说法正确的是 ______
A.![]() 中所含的化学键有离子键、极性键和配位键
中所含的化学键有离子键、极性键和配位键
B.在![]() 中
中![]() 给出孤电子对,
给出孤电子对,![]() 提供空轨道
提供空轨道
C.![]() 组成元素中第一电离能最大的是氧元素
组成元素中第一电离能最大的是氧元素
D.![]() 与
与![]() 互为等电子体,空间构型均为正四面体
互为等电子体,空间构型均为正四面体
![]() 氨基乙酸铜的分子结构如图,碳原子的杂化方式为______。该分子中
氨基乙酸铜的分子结构如图,碳原子的杂化方式为______。该分子中![]() 键与
键与![]() 键个数比值为 ______
键个数比值为 ______

![]() 在硅酸盐中,
在硅酸盐中,![]() 四面体
四面体![]() 如图
如图![]() 通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根,Si与O的原子数之比为 ______ ,化学式为 ______ 。
通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根,Si与O的原子数之比为 ______ ,化学式为 ______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是( )
A.2SO2 + O2![]() 2SO3 △H= -196.6kJ/mol
2SO3 △H= -196.6kJ/mol
B.N2(g)+2O2(g)=2NO2(g) △H= +67.7kJ/mol
C.C(s)+O2(g)=CO2(g) △H= +393.5kJ/mol
D.H2O(l)==H2(g)↑+1/2O2(g)↑ △H= +285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁﹣次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣下列有关说法正确的是( )
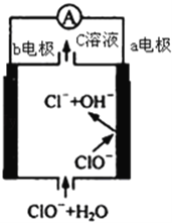
A. 电池工作时,C溶液中的溶质是MgCl2
B. 电池工作时,正极a附近的pH将不断增大
C. 负极反应式:ClO﹣﹣2e﹣+H2O═Cl﹣+2 OH﹣
D. b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000molL-1NaOH溶液滴定20.00ml0.1000molL-1的丙二酸(用H2A表示)的滴定曲线如图所示(pK=-lgK):( )

下列说法错误的是
A.a点: c(HA-)=c(H2A)
B.b点:c(HA-)>c(A2-)> c(H2A)
C.c点:c(Na+)>3c(A2-)
D.溶液中水的电离程度:d>c>b>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com