
【题目】利用铜—氯热化学循环可制取氢气,主要流程如下:
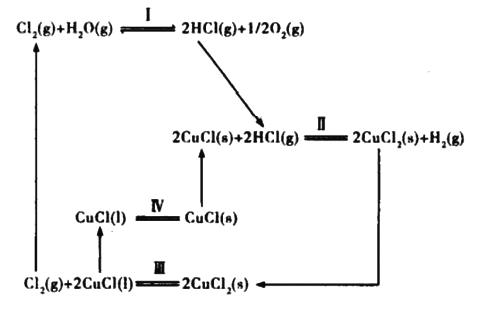
回答下列问题:
(1)图中属于氧化还原反应的是__________(填序号)。
(2)已知25℃时,Ksp(CuOH)=2.0×10-15,Ksp(CuC1)=1.0×10-6,则反应CuC1(s)+H2O(1)![]() CuOH(s)+Cl-(aq)+H+(aq)的平衡常数K=___________(填数值)。
CuOH(s)+Cl-(aq)+H+(aq)的平衡常数K=___________(填数值)。
(3)已知:
Cl2(g)+H2O(g)==2HCl(g)+1/2O2(g) △H1
2CuCl(s)+2HCl(g)==2CuCl2(s)+H2(g) △H2
Cl2(g)+2CuCl(l)==2CuCl2(s) △H3
CuC1(l)==CuC1(s) △H4
则反应H2O(g)==H2(g)+1/2O2(g) △H=_______(用△H1、△H2、△H3、△H4表示)。
(4)反应Ⅱ若在水溶液中进行可用惰性电极电解实现,其装置如下图所示。阳极的电极反应式为____________________;电解过程中阳极周围溶液的pH__________(填“升高”或“降低”)。

(5)反应I是可逆反应,工业上也常用该反应生成的HC1制取氯气,反应为4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g),在不同起始投料比m下,HC1平衡转化率随温度的变化关系如下图所示:
2Cl2(g)+2H2O(g),在不同起始投料比m下,HC1平衡转化率随温度的变化关系如下图所示:
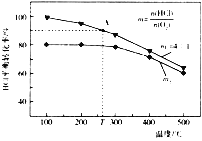
①该反应的正反应为___________热反应(填“放”或“吸”)。
②图中m2________m1(填“>”或“<”)。
③p kPa下,A点对应温度下反应的平衡常数Kp=________kPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,列出计算式即可)。
【答案】 I、II、III 5×10-6 △H1+△H2-△H3+2△H4 CuCl-e-=Cu2++Cl- 升高 放 > ![]()
【解析】(1)Ⅳ是物理变化,其余三个反应中均涉及元素化合价的变化,故反应I、II、III均是氧化还原反应;(2)K=c(H+)c(Cl-)=![]() =
=![]() =5×10-6;(3)由I+II-III+2Ⅳ可得反应H2O(g)==H2(g)+1/2O2(g),根据盖斯定律可得:△H=△H 1+△H2-△H3+2△H4;(4)阳极上CuCl被氧化为CuCl2,反应的电极反应式为:CuCl-e-=Cu2++Cl-;阴极上H+得到电子生成H2,由于H+透过质子交换膜,故阳极周围溶液的PH升高;(5)①根据图中信息可知,温度升高,HC1平衡转化率降低,则平衡向逆反应方向移动,逆反应方向为吸热反应,则该反应的正反应为放热反应;②当氧气一定时,HC1投入比越大,HC1平衡转化率越低,故图中m2>m1;③ 4HCl(g)+O2(g)
=5×10-6;(3)由I+II-III+2Ⅳ可得反应H2O(g)==H2(g)+1/2O2(g),根据盖斯定律可得:△H=△H 1+△H2-△H3+2△H4;(4)阳极上CuCl被氧化为CuCl2,反应的电极反应式为:CuCl-e-=Cu2++Cl-;阴极上H+得到电子生成H2,由于H+透过质子交换膜,故阳极周围溶液的PH升高;(5)①根据图中信息可知,温度升高,HC1平衡转化率降低,则平衡向逆反应方向移动,逆反应方向为吸热反应,则该反应的正反应为放热反应;②当氧气一定时,HC1投入比越大,HC1平衡转化率越低,故图中m2>m1;③ 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
起始时的物质的量/mol 4a a 0 0
转化的物质的量/mol 3.6a 0.9a 1.8a 1.8a
平衡时的物质的量/mol 0.4a 0.1a 1.8a 1.8a
总物质的量为0.4a+0.1a+1.8a+1.8a=4.1a,HCl、O2、Cl2及H2O(g)的物质的量分数分别为![]() 、
、![]() 、
、![]() 、
、![]() 。K=
。K=![]() =
=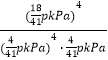 =
=![]() kPa-1。
kPa-1。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】可燃冰是一种天然气水合物,其主要成分为CH4nH2O,分布于深海沉积物或陆域的永久冻土中,下列有关说法正确的是( )
A. 可燃冰是一种清洁能源
B. CH4nH2O是一种离子化合物
C. 可燃冰在常温常压下能稳定存在
D. 可燃冰是天然气冷却后得到的固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | Na2O2 | NaOH | NaCl | ①常温遇水 |
B | Al2O3 | NaAl(OH)4 | Al(OH)3 | ②通入CO2 |
C | NO | NO2 | HNO3 | ④加入铜粉 |
D | C | CO | CO2 | ③点燃镁条 |
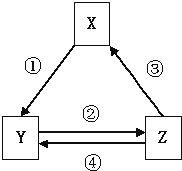
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,被氧化与被还原的元素是同一元素的是( )
A.Cl2+2NaOH═NaCl+NaClO+H2O
B.Fe+CuSO4═FeSO4+Cu
C.2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
D.3NO2+H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(ρ=1.84g/cm3)配制1mol/L稀硫酸100mL.
(1)实验中应选用的仪器是(填字母).
A.1000mL量筒 B.托盘天平
C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.50mL烧杯
G.100mL容量瓶 H.胶头滴管
(2)实验操作:
a.用100mL量筒量取98%的浓硫酸mL;
b.选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的硫酸溶液沿玻璃棒转移到此容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒23次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至离刻度线12cm处;
f.盖上容量瓶瓶塞,摇匀;
g.用胶头滴管小心加蒸馏水至刻度线;
h.将配制好的溶液转移入含少量蒸馏水的试剂瓶中贮存备用.
(3)实验分析:
①正确的操作步骤是(填序号).
②此实验中玻璃棒的作用是 .
③实验操作中有两处错误,这两处错误是:
I. .
II. .
④下列操作对所配溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
Ⅰ. 转移硫酸后,小烧杯未洗涤 .
Ⅱ.量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中 .
Ⅲ.定容时俯视容量瓶刻度线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法不正确的是( )
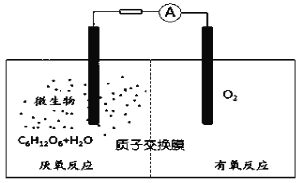
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从正极区移向负极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的、以碘离子形式存在的碘元素.在实验室中,从海藻里提取碘的流程和实验装置如下: 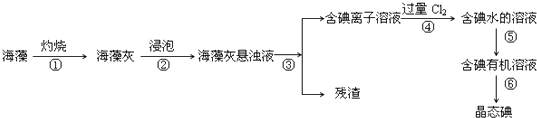
(1)写出步骤④对应反应的离子方程式: .
(2)步骤④除了加入过量Cl2 , 下列氧化剂最好选用(填代号).
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
理由是 .
(3)步骤⑤中,某学生选择用苯提取碘的理由是 .
(4)设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com