
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
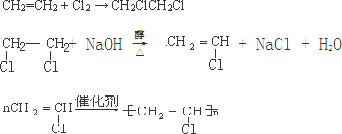 .
. 分析 (1)乙炔水化法是乙炔和水加成反应得到制乙醛,乙烯氧化法是乙烯被催化氧化生成制乙醛;
(2)对比“乙烯氧化法”、“乙炔水化法”两种方法,从化学反应速率、日产量、消耗的催化剂的性质以及能源的消耗角度来回答;
(3)从表一来看,两者反应条件温度相当,虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多;
从表二来看,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,较难获得;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得;
(4)依据转化率,增大压强消耗能源,增大投入等因素分析;
(5)以乙烯为原料,通过3步可以制得聚氯乙烯,方案为乙烯和氯气发生加成反应生成1,2-二氯乙烷,1,2-二氯乙烷在氢氧化钠溶液中发生消去反应得到氯乙烯,在引发剂作用下发生聚合反应生成聚乙烯.
解答 解:(1)乙炔水化法是乙炔和水加成反应得到制乙醛,反应的化学方程式为:CH≡CH+H2O$→_{△}^{催化剂}$CH3CHO,
乙烯氧化法是乙烯被催化氧化生成制乙醛,反应的化学方程式为:2CH2=CH2+O2$→_{△}^{催化剂}$2CH3CHO,
故答案为:CH≡CH+H2O$→_{△}^{催化剂}$CH3CHO,2CH2=CH2+O2$→_{△}^{催化剂}$2CH3CHO;
(2)对比“乙烯氧化法”、“乙炔水化法”两种方法,从环境保护和能耗角度可以知道,两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,汞盐的毒性大,从产率和产量角度可以看出:虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多,
对比“乙烯氧化法”、“乙炔水化法”两种方法,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,但是乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得等,
故答案为:两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,汞盐的毒性大,虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,但是乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得等;
(3)从表一来看,两者反应条件温度相当,虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多;
从表二来看,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,较难获得;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得,所以从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法中乙烯氧化法快,
故答案为:乙烯氧化法快;
(4)若将上述两种方法的反应条件,均增加“100个标准大气压”,原料转化率会再增大一些,但在实际生产中却不采用这样的方法是因为两种方法在相同反应条件下,转化率已经很高,增大压强将消耗能量和增加设备预算,不经济,
故答案为:因为两种方法在相同反应条件下,转化率已经很高,增大压强将消耗能量和增加设备预算,不经济;
(5)以乙烯为原料,通过3步可以制得聚氯乙烯,方案为乙烯和氯气发生加成反应生成1,2-二氯乙烷,1,2-二氯乙烷在氢氧化钠溶液中发生消去反应得到氯乙烯,在引发剂作用下发生聚合反应生成聚乙烯,反应的化学方程式为: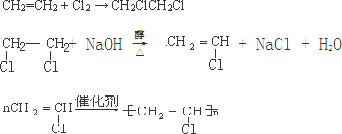 ,
,
故答案为: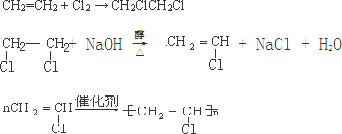 .
.
点评 本题考查有机物的合成及计算,注意表格数据的分析和物质的合成的关系,能利用数据和流程分析判断是解题关键,对学生能力的考查较高,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2HCl+2Na═2NaCl+H2↑ | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)3 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0~1min,CO的平均反应速率为o.5mol/(L•min) | |
| B. | 增大压强,化学反应速率加快,K增大 | |
| C. | H2S的平衡转化率为71.4% | |
| D. | 平衡后,又加入CO、H2各1mol,平衡逆动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度 | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| B. | 甲苯与浓硫酸和浓硝酸混酸反应生成2,4,6-三硝基甲苯 | |
| C. | 1mol甲苯能与3mol氢气发生加成反应 | |
| D. | 甲苯可以燃烧并产生浓烈的黑烟 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com