
| 元素 | Mn | Fe | |
| 电离能/mol | I1 | 717 | 758 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
分析 (1)A.甲醛中氧元素电负性很大,与水分子中H原子可以形成氢键;
B.CH2O分子中C原子形成3个σ键,而CO2分子中C原子形成2个σ键,均没有孤电子对;
C.C6H6分子中含有12个σ键和1个大π键;
D.二氧化碳晶体属于分子晶体,二氧化硅属于原子晶体.
(2)Mn元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理书写其基态原子核外电子排布式;原子轨道处于半满、全满、全空时能量更低稳定;
(3)原子核外没有运动状态相同的电子;
(4)根据电子最后填充的能级分区,元素周期表分成五个区域,包括:s区、p区、d区、ds区、f区,s区为第ⅠA、ⅡA族,p区为第ⅢA到零族,d区包括从第ⅢB族到八族,ds区为第ⅠB、ⅡB族,f区为镧系和锕系;
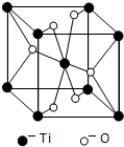
(5)根据均摊法计算晶胞中Ti、O原子数目确定化学式;
(6)①同周期从左向右电负性逐渐增大,非金属性越强电负性越大;
②原子总数相等、价电子或电子总数相等的微粒互为等电子体;
③氰酸(HOCN)是一种链状分子,其分子内各原子最外层均已达到稳定结构,分子中碳为四价,氮为三价,氧为两价.
解答 解:(1)A.甲醛中氧元素电负性很大,与水分子中H原子可以形成氢键,故A正确;
B.CH2O分子中C原子形成3个σ键,而CO2分子中C原子形成2个σ键,均没有孤电子对,HCHO分子中C原子采用sp2杂化,二氧化碳分子中C原子为sp杂化,故B错误;
C.C6H6分子中含有12个σ键和1个大π键,故C错误;
D.二氧化碳晶体是分子晶体,二氧化硅晶体是原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,故D正确,
故答案为:AD;
(2)Mn元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理书写其基态原子核外电子排布式为[Ar]3d54s2,其价电子排布式为3d54s2;
Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(3)Fe原子核外有26个电子,原子核外没有运动状态相同的电子,故核外有26个运动状态不同的电子,
故答案为:26;
(4)元素周期表分成五个区域,包括:s区、d区、ds区、p区、f区,s区为第ⅠA、ⅡA族,p区为第ⅢA到零族,d区包括从第ⅢB族到八族,ds区为第ⅠB、ⅡB族,f区为镧系和锕系,其中钛位于第ⅣB族,属于d区;
故答案为:d;
(5)每个晶胞中含有Ti原子数为8×$\frac{1}{8}$+1=2,氧原子数为4×$\frac{1}{2}$+2=4,故化学式为TiO2,
故答案为:TiO2;
(6)①同周期从左向右电负性逐渐增大,非金属性越强电负性越大,故电负性大小为H<C<N<O,
故答案为:H<C<N<O;
②与CNO-互为等电子体微粒的化学式为CO2、N2O、SCN-等,
故答案为:CO2、N2O、SCN-等;
③碳为四价,氮为三价,氧为两价,氰酸(HOCN)是一种链状分子,且其分子内各原子最外层均已达到稳定结构,故其结构式为:N≡C-O-H,
故答案为:N≡C-O-H.
点评 本题是对物质结构与性质的考查,涉及氢键、杂化方式、化学键、晶体类型与性质、电负性、电离能、核外电子排布、元素周期表结构、晶胞计算、等电子体、分子结构等,是对物质结构主干知识的综合考查,需要学生具备扎实的基础,难度中等.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题

| A. | 甲池是电解池,乙池是原电池;A电极反应式为:C2H5OH+3H2O-12e-═2CO2+12H+ | |
| B. | 反应一段时间后,两池溶液的pH均未变化 | |
| C. | 假如乙池中加入K2SO4溶液,隔膜只允许K+通过,当电路中转移0.01mol e-时,则隔膜左侧溶液中最终减少离子约0.02mol | |
| D. | 假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
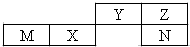 五种短周期元素在元素周期表中的位置如图,其中只有一种为金属元素.下列说法正确的是( )
五种短周期元素在元素周期表中的位置如图,其中只有一种为金属元素.下列说法正确的是( )| A. | 简单离子半径大小:M>N>Z | |
| B. | 最简单气态氢化物的沸点高低:N>Z>Y | |
| C. | M的最高价氧化物可与N的最高价氧化物对应水化物反应 | |
| D. | N单质可与Z的最简单氢化物反应置换出Z单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表为元素周期表前四周期,其中的字母代表相应的元素.
如表为元素周期表前四周期,其中的字母代表相应的元素.| a | |||||||||||||||||
| b | c | d | |||||||||||||||
| e | f | g | k | ||||||||||||||
| h | I | j |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于10.00mL | B. | 小于10.00Ml | C. | 等于10.00mL | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
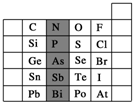 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
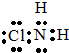 ,从物质结构的角度解释两者熔点相差较大的原因氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,熔沸点离子晶体高于分子晶体.
,从物质结构的角度解释两者熔点相差较大的原因氯胺NH2Cl为分子晶体,NH4Cl为离子晶体,熔沸点离子晶体高于分子晶体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com