
| A. | 物质A的转化率小了 | B. | 平衡向正反应方向移动了 | ||
| C. | 物质B的质量分数减小了 | D. | b>a |
分析 先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动,即减小压强平衡向正反应方向移动,则a<b,据此结合选项判断.
解答 解:A.先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动,即减小压强平衡向正反应方向移动,反应物转化率增大,故A错误;
B.根据A的判断,实际平衡时B的浓度比假设大,说明平衡向生成B的方向移动,平衡向正反应方向移动了,故B正确;
C.平衡向正反应移动,B的质量增大,混合气体的总质量不变,故物质B的质量分数增大,故C错误;
D.根据A的判断,平衡向生成B的方向移动,减小压强平衡向正反应方向移动,则a<b,故D正确;
故选BD.
点评 本题考查化学平衡移动等,难度不大,注意利用假设法分析、判断平衡移动方向.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 从溴水中萃取溴,可用酒精做萃取剂 | |
| B. | 蒸发实验完毕后,发现蒸发皿炸裂,这是因为没有垫石棉网 | |
| C. | 萃取碘水溶液中碘,分离碘四氯化碳溶液时,眼睛注视分液漏斗里液面 | |
| D. | 蒸馏时,为了加快水的流速,水应从上口进入,下口流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,请根据要求回答下列问题:| 同一反应时间 | 同一反应温度 | |||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* | |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 | |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 | |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 | |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
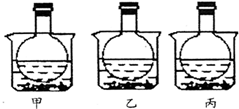 如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )
如图所示,三个烧瓶中分别充满等量的NO2气体并分别放置在盛有水的烧杯中,在甲中加入CaO固体,在乙中加入NH4NO3晶体,在丙中加入NaCl固体.下列叙述正确的是( )| A. | 甲烧瓶中气体颜色变浅 | B. | 乙烧瓶中气体颜色变深 | ||
| C. | 丙烧瓶中气体压强明显增大 | D. | 上述三种说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,4 v正(O2)=5 v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 达到平衡时,若减小容器体积,则NH3的转化率会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠 食盐 NaCl2 | B. | 碳酸氢钠 纯碱 NaHCO3 | ||
| C. | 氢氧化钠 烧碱 NaOH | D. | 氢氧化钙 熟石灰 CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com