
【题目】元素X、Y、Z均位于短周期,它们的最高及最低化合价如下表所示,下列判断一定正确的是

A. 原子序数:X>Y>Z.
B. Z的氢化物的沸点在同族中最高
C. X的含氧酸的酸性最强
D. Y的一种同素异形体具有漂白能力
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
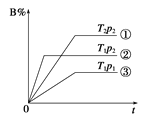
A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来升炼倭铅(即锌),其原理如图。已知锌的熔点420 ℃、沸点906 ℃。则下列说法不正确的是
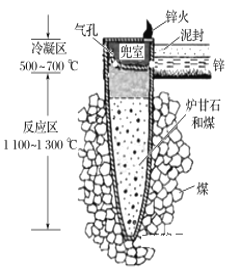
A. 升炼倭铅过程包含分解反应和氧化还原反应
B. 冶炼时锌变为蒸气在兜室冷凝为固体
C. “泥封”的目的是为了防止得到的锌被氧化
D. “锌火”是锌蒸气和一氧化碳在空气的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度下:①N2(g)+O2(g)===2NO(g) ΔH1=+180 kJ·mol-1 ②N2(g)+3H2(g)![]() 2NH3(g) ΔH2=-92.4 kJ·mol-1 ③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1下列说法正确的是( )
2NH3(g) ΔH2=-92.4 kJ·mol-1 ③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1下列说法正确的是( )
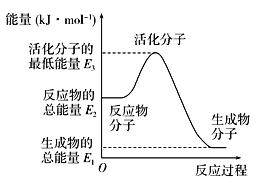
A. 反应②中的能量变化如上图所示,则ΔH=E1-E3
B. 2 mol H2(g)完全燃烧生成液态水时放出的热量小于483.6 kJ
C. 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
D. 氨催化氧化反应为4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池充电时间短,续航能力强,其充放电原理为VO2++V3++H2O![]() VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是
VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是

A. 全钒液流电池放电时,正极的电极反应式为VO2++2H++e-=VO2++H2O
B. 图中a电极为阴极,N物质是H2
C. 全钒液流电池充电时,V3+被氧化为VO2+
D. 电解时,b电极的反应式为SO32-+H2O-2e-=SO42-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。在密闭容器中发生该反应时
2CO2(g)+N2(g)。在密闭容器中发生该反应时
,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

据此判断:
①该反应的温度T2____ T1 (填“>”或“<”)。
②在T1温度下,0~2 s内的平均反应速率v(N2)=___________。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若增大催化剂的表面积,则CO转化率__ (填“增大”“减小”或“不变”)。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是____(填字母)。

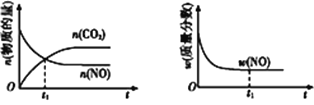
a b c
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ/mol
2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ/mol
N2O4(g) ΔH=-56.9 kJ/mol
写出CH4催化还原N2O4(g)生成N2、CO2和H2O(g)的热化学方程式:_________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极a、b表面发生的电极反应式分别为a:____________________,
b:___________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速率的主要因素是
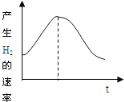
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A. ①④ B. ③④ C. ①③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用如图所示装置制取少量乙酸乙酯。请回答下列问题:
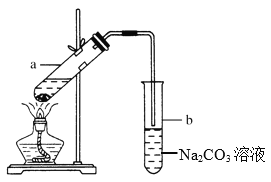
(1)试管a中需加入浓硫酸、乙酸各2 mL,乙醇3 mL,应该先加入________,最后加入________。
(2)试管a中发生反应的化学方程式是_____________,反应类型是_______,通常加入几片碎瓷片,其作用是_____________。
(3)反应结束后,振荡试管b,静置。观察到的现象是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com