
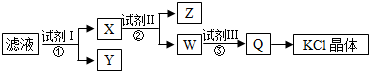
| A. | 图示的步骤中必需要经过2次过滤操作 | |
| B. | 起始滤液呈中性 | |
| C. | 试剂Ⅱ为Na2CO3溶液 | |
| D. | 试剂Ⅲ为盐酸 |
分析 氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,除去碳酸根离子和硫酸根离子,由流程可知,需要加入试剂I为过量氯化钡溶液,然后过滤后获得含氯化钡、氯化钾溶液X,然后加入过量的试剂Ⅱ为碳酸钾溶液除去溶液中的氯化钡,过滤,得到含氯化钾和碳酸钾混合液的W,再加入试剂Ⅲ为过量盐酸,除去过量的碳酸钾,最后通过加热浓缩、蒸发结晶得到氯化钾,以此来解答.
解答 解:氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,除去碳酸根离子和硫酸根离子,由流程可知,需要加入试剂I为过量氯化钡溶液,然后过滤后获得含氯化钡、氯化钾溶液X,然后加入过量的试剂Ⅱ为碳酸钾溶液除去溶液中的氯化钡,过滤,得到含氯化钾和碳酸钾混合液的W,再加入试剂Ⅲ为过量盐酸,除去过量的碳酸钾,最后通过加热浓缩、蒸发结晶得到氯化钾,
A.样品溶于适量水中,充分搅拌后过滤,选择试剂除去杂质还需要2次过滤,共3次,故A错误;
B.碳酸钾溶液水解显碱性,pH>7,故B错误;
C.步骤②中加入试剂Ⅱ为碳酸钾,其目的是除去Ba2+,故C错误;
D.由上述分析可知,试剂Ⅲ为过量盐酸,不能引入新杂质,故D正确;
故选D.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握物质的性质、流程中的反应及混合物分离方法为解答的关键,侧重分析、实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
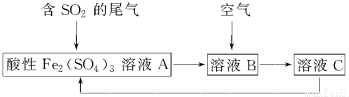
| A. | 溶液B中发生的反应为2SO2+O2═2SO3 | |
| B. | 可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+ | |
| C. | 由以上流程可推知氧化性:Fe3+>O2>SO42- | |
| D. | 此工艺的优点之一是物质能循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
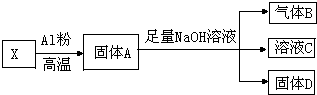 某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)
某同学设计实验将Fe3O4和CuO组成的混合物X进行如图所示的转化(每一步均反应完全)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
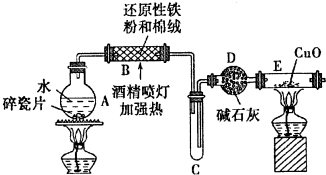
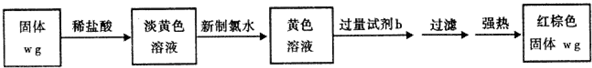
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
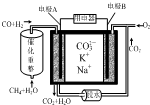
| A. | 电极A为正极,发生了还原反应 | |
| B. | 电极A上CO参与的电极反应为:CO+O2--2e-═CO2 | |
| C. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- | |
| D. | 电池工作时,K+向电极A移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下加入浓硫酸 | |
| D. | 上述说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
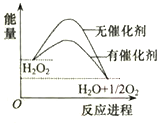
| A. | 元素O的单质存在O2和O3两种同位素 | |
| B. | 加入催化剂,减小了H2O2分解反应的热效应 | |
| C. | 若H2O2分解产生1molO2,理论上转移4mol电子 | |
| D. | H2O2和Na2O2所含化学键类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
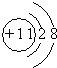 ;
;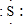 ,E离子的符号为Cl-;
,E离子的符号为Cl-;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| B. | 在一定条件下,苯分别与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| D. | 聚合物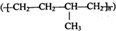 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com