
| A. | 用丁达尔效应鉴别Fe(OH)3胶体和淀粉溶液 | |
| B. | 用渗析的方法除去淀粉胶体含有少量NaCl | |
| C. | 用溶解、过滤、洗涤固体的方法提纯含有少量BaSO4的Na2CO3 | |
| D. | 用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
分析 A.丁达尔现象为胶体特有的性质;
B.胶体不能透过半透膜,而离子可以;
C.硫酸钡不溶于水,碳酸钠溶于水;
D.CaCl2、MgCl2等杂质均溶于水.
解答 解:A.丁达尔现象为胶体特有的性质,Fe(OH)3胶体和淀粉溶液均为胶体分散系,则丁达尔现象不能鉴别,故A错误;
B.胶体不能透过半透膜,而离子可以,则用渗析的方法除去淀粉胶体含有少量NaCl,故B正确;
C.硫酸钡不溶于水,碳酸钠溶于水,则用溶解、过滤、洗涤固体的方法可得到BaSO4,蒸发滤液得到Na2CO3,故C错误;
D.CaCl2、MgCl2等杂质均溶于水,则加热、蒸发不能除杂,应加化学试剂将杂质转化为沉淀,再过滤除杂,故D错误;
故选B.
点评 本题考查物质的检验和鉴别,为高频考点,把握物质的性质、性质差异及混合物分离提纯方法等为解答的关键,注意除杂的原则,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Fe与S混合加热生成FeS | |
| B. | Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落 | |
| C. | 检验SO2气体中是否含有CO2气体,可将气体先通入饱和碳酸氢钠溶液,再通入品红溶液,最后通入澄清石灰水溶液 | |
| D. | 氯化氢水溶液能导电,所以氯化氢是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +(a+b)kJ•mol-1 | B. | +(a-b)kJ•mol-1 | ||
| C. | +(a+3b)kJ•mol-1 | D. | +(0.5a+1.5b)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 溶解 过滤 结晶 | B. | 溶解 过滤 蒸发 结晶 | ||
| C. | 加热 溶解 蒸发 过滤 | D. | 溶解 过滤 蒸馏 蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉可长期放置在烧杯中 | |
| B. | 金属钠燃烧时不能用水灭火,应该用沙子灭火 | |
| C. | 氯水可以用无色透明的试剂瓶装保存 | |
| D. | 实验后剩余的钠不可放回原试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 使用分液漏斗和容量瓶时,首先要查漏 | |
| B. | 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体暴沸 | |
| C. | 向试管中加液体时,胶头滴管紧贴试管内壁 | |
| D. | 用蒸发皿进行加热蒸发时,一定要垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
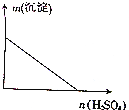 向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )
向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )| A. | 硝酸钙与硫酸钾的混合液 | B. | 氯化钡与碳酸钠的混合液 | ||
| C. | 硫酸镁与氢氧化钾的混合液 | D. | 氯化铝与硝酸钠的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
(1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com