
【题目】某药物H的合成路线如下:
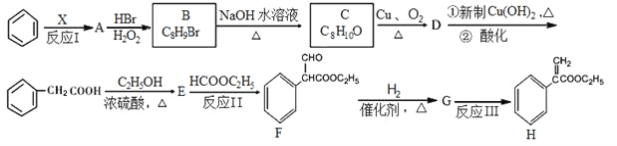
试回答下列问题:
(1)反应Ⅰ所涉及的物质均为烃,氢的质量分数均相同,则X的结构式为__________,A的名称为___________。
(2)反应Ⅱ的反应类型是________________。
(3)B的结构简式是____________;E的分子式为___________;F中含氧官能团的名称是_________。
(4)由C→D反应的化学方程式为______________。由G→H反应的化学方程式为_____________。
(5)化合物G酸性条件下水解产物之一M有多种异构体,满足下列条件的结构有_______种。
①能发生水解反应和银镜反应;②能与FeCl3发生显色反应;③苯环上只有两个取代基。
(6)参照上述合成路线,设计一条由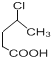 制备
制备![]() 的合成路线流程__________________。
的合成路线流程__________________。
【答案】 H—C≡C—H 苯乙烯 取代反应  C10H12O2 醛基、酯基
C10H12O2 醛基、酯基 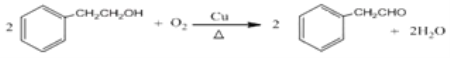
 6
6 
【解析】根据合成线路可知,D与新制Cu(OH)2加热条件下反应,酸化后得苯乙酸,则D的结构简式为:![]() ;C催化氧化生成D,则C的结构简式为:
;C催化氧化生成D,则C的结构简式为:![]() ;B水解生成C,则B的结构简式为:
;B水解生成C,则B的结构简式为:![]() ;A与溴化氢在双氧水的作用下发生加成反应生成B,所以A为苯乙烯,反应Ⅰ所涉及的物质均为烃,氢的质量分数均相同,比较苯与A的结构可知,苯与X发生加成反应生成A,所以X为CH≡CH,苯乙酸与乙醇在浓硫酸作用下发生酯化反应生成E为
;A与溴化氢在双氧水的作用下发生加成反应生成B,所以A为苯乙烯,反应Ⅰ所涉及的物质均为烃,氢的质量分数均相同,比较苯与A的结构可知,苯与X发生加成反应生成A,所以X为CH≡CH,苯乙酸与乙醇在浓硫酸作用下发生酯化反应生成E为![]() ,E发生取代反应生成F,F与氢气发生加成,醛基转化为羟基,则G的结构简式为:
,E发生取代反应生成F,F与氢气发生加成,醛基转化为羟基,则G的结构简式为:![]() ,G发生消去反应生成H。
,G发生消去反应生成H。
(1)根据上面的分析可知,X为CH≡CH,A为苯乙烯,故答案为:H—C≡C—H;苯乙烯;
(2)根据上面的分析可知,反应Ⅱ的反应类型是取代反应,故答案为:取代反应;
(3)B的结构简式为:![]() ,E为
,E为![]() ,E的分子式为 C10H12O2,根据F的结构简式可知,F中含氧官能团的名称是醛基、酯基,故答案为:
,E的分子式为 C10H12O2,根据F的结构简式可知,F中含氧官能团的名称是醛基、酯基,故答案为:![]() ;C10H12O2;醛基、酯基;
;C10H12O2;醛基、酯基;
(4)由C→D反应是![]() 催化氧化,反应的化学方程式为
催化氧化,反应的化学方程式为![]() ,G发生消去反应生成H,反应的化学方程式为
,G发生消去反应生成H,反应的化学方程式为 ,故答案为:
,故答案为:![]() ;
; ;
;
(5)G的结构简式为:![]() ,在酸性条件下水解产物之一M为
,在酸性条件下水解产物之一M为![]() ,
,![]() 有多种同分异构体,同时满足下列条件:与FeCl3溶液发生显色反应,含有酚羟基;能发生水解反应和银镜反应,说明含有甲酸形成的酯基,苯环上有两个取代基,符合条件的同分异构体为苯环上连有-OH、HCOOCH2CH2-,或-OH、HCOOCH(CH3)-,/span>均存在邻、间、对位3种,共有6种结构,故答案为:6;
有多种同分异构体,同时满足下列条件:与FeCl3溶液发生显色反应,含有酚羟基;能发生水解反应和银镜反应,说明含有甲酸形成的酯基,苯环上有两个取代基,符合条件的同分异构体为苯环上连有-OH、HCOOCH2CH2-,或-OH、HCOOCH(CH3)-,/span>均存在邻、间、对位3种,共有6种结构,故答案为:6;
(6)由 制备
制备![]() ,可以用
,可以用 依次通过消去反应得到碳碳双键,在H2O2条件下与HBr加成,Br在端点的C原子上,水解反应生成-OH,然后发生酯化反应得最终产物,所以合成路线图为:
依次通过消去反应得到碳碳双键,在H2O2条件下与HBr加成,Br在端点的C原子上,水解反应生成-OH,然后发生酯化反应得最终产物,所以合成路线图为: ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的一组是( )
①糖类、油脂、蛋白质在一定条件下都能发生水解
②制造婴儿用的一次性纸尿片采用的吸水保水的材料可以是![]()
③石油的分馏、裂化和煤的干馏都是化学变化
④葡萄糖与果糖、淀粉与纤维素均互为同分异构体
⑤淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2发生反应
⑥塑料、橡胶和纤维都是合成高分子材料
⑦向蛋白质溶液中加入饱和CuSO4溶液,出现盐析现象,加水溶解
A. ②⑤ B. ①⑤⑦ C. ③④⑥ D. ②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们生活水平的不断提高和环境保护意识的不断增强,家庭绿化日益普及。对绿色观叶植物适当补充镁元素,可使其正常生长,其原因是( )
A. 镁是合成蛋白质的原料
B. 镁是合成核酸的原料
C. 镁能够促进植物对水分的吸收
D. 镁是组成叶绿素的重要元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:SO2+2H2O+I2=H2SO4+2HI; 向含SO32-、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验事实:
(1)X+Y2+=X2++Y;(2)Z+2H2O![]() Z(OH)2+H2↑;(3)Z2+离子的放电能力比X2+弱;(4)由Y、W 作电极组成的原电池反应为:Y-2e-=Y2+,由此可知,X、Y、Z、W的还原性由强到弱的顺序是
Z(OH)2+H2↑;(3)Z2+离子的放电能力比X2+弱;(4)由Y、W 作电极组成的原电池反应为:Y-2e-=Y2+,由此可知,X、Y、Z、W的还原性由强到弱的顺序是
A. X > Y > Z > WB. Y > X > W > Z
C. Z > X > Y > WD. Z > Y > X > W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:

(1)制备该工艺流程需用Fe2+
甲同学方案:
用部分生锈的废铁屑与稀硫酸反应制备Fe2+,检验溶液中是否含有Fe3+试剂是______。
A.铁氰化钾 B.硫氰化钾 C.酸性高锰酸钾溶液
制备中除发生反应Fe+2H+ ![]() Fe2++H2↑外,其他可能反应的离子方程式为__________。
Fe2++H2↑外,其他可能反应的离子方程式为__________。
乙同学方案:
把一块纯净的铁片插入装有稀硫酸的烧杯里,可观察到铁片上有气泡,在平行插入一块铜片,可观察到铜片上______(填“有”或“没有”)气泡产生,再用导线把铁片和铜片连接起来,组成一个原电池,正极的电极反应式为______________________。
(2)工艺流程中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,若平衡体系的pH=2,则溶液显________色。
Cr2O72-(橙色)+H2O,若平衡体系的pH=2,则溶液显________色。
(3)工艺流程中第②步中,还原1mol Cr2O72-离子,需要_______mol的FeSO4·7H2O。
(4)工艺流程中第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(H+) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的逆反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. NH4+、Al3+、Cl-、HCO3-在溶液中能大量共存
B. H2O2的电子式是:![]()
C. AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D. 铁锈是化合物,可用Fe2O3·nH2O(2<n<3)表示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com