
| A、原子半径:Y>Z>W |
| B、非金属性最强的元素为W |
| C、Y的最高价氧化物对应的水化物为强碱 |
| D、XW2分子中各原子最外层电子未达到8电子结构 |


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、1mol苯乙烯含有的C=C数为4NA |
| B、2.8克乙烯和丙烯的混合气体中所含碳原子数为0.2 NA |
| C、1 mol羟基所含的电子总数为10NA |
| D、标准状况下,11.2 L己烷所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 贝诺酯是一种治疗类风湿险关节炎药物,其结构简式如图所示,下列关于贝诺酷的描述正确的是( )
贝诺酯是一种治疗类风湿险关节炎药物,其结构简式如图所示,下列关于贝诺酷的描述正确的是( )| A、贝诺酷使溴水和酸性高锰酸钾溶液褪色的原理相同 |
| B、贝诺醋中含有3种含氧官能团 |
| C、1 mol贝诺酷最多可以消耗9 mol H2 |
| D、1 mol贝诺醋最多可以消耗5 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫既可作氧化剂,也可作还原剂 |
| B、硫酸铜晶体中加入浓硫酸,蓝色晶体变为白色粉末,是因为浓硫酸具有脱水性 |
| C、可用铁罐贮运冷的浓硫酸 |
| D、医药上常用硫酸钡作X射线透视肠胃的内服药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、布朗运动是胶体粒子特有的运动方式,可以据此把胶体、溶液和悬浊液区分开来 |
| B、胶体和溶液的本质区别是胶体能发生丁达尔效应 |
| C、用过滤的方法可以分离胶体和悬浊液 |
| D、胶体带电,故在电场作用下会产生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
| B、将氨通入盐酸溶液中:NH3+H+═NH4+ |
| C、在漂白粉溶液中通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| D、将少量铜屑放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2中既有σ键又有π键 |
| B、该反应中,每消耗11.2L的氧气,乙醚失去的电子数为12.4×10-23 |
| C、1-乙氧基氢过氧化物中只有极性键没有非极性键 |
| D、起麻醉作用的是l-乙氧基氢过氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
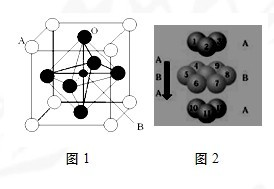 过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com