
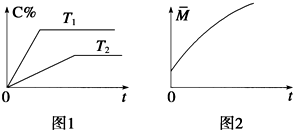
 在密闭容器中投入一定量的A和B发生反应:
在密闭容器中投入一定量的A和B发生反应:分析 (1)根据图1可知T1线的起始斜率大于T2,则说明温度T1>T2,而平衡时C的百分含量T1的高,说明升高温度时平衡正向移动,所以该反应的正反应为吸热反应,据此答题;
(2)根据图乙可知,从正反应开始达到化学平衡过程中,混合气体的平均相对分子质量逐渐增大的,而反应中气体质量是守恒的,所以m+n>p+q,
①若在恒温恒容的条件下,向该平衡体系中再通入A、B、C、D1mol,即相当于对原平衡加压,平衡向正反应方向移动,气体的平均相对分子质量会增大,据此答题;
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1mol,相当于体积增大到原来的2倍,气体的总质量也为原来的2倍,平衡不移动,气体的密度也不变,据此答题.
解答 解:(1)根据图1可知T1线的起始斜率大于T2,则说明温度T1>T2,而平衡时C的百分含量T1的高,说明升高温度时平衡正向移动,所以该反应的正反应为吸热反应,
故答案为:>;>;
(2)根据图2可知,从正反应开始达到化学平衡过程中,混合气体的平均相对分子质量逐渐增大的,而反应中气体质量是守恒的,根据n=$\frac{m}{M}$,知该反应是一个气体体积减小的反应,即p+q<m+n,
①若在恒温恒容的条件下,向该平衡体系中再通入A、B、C、D1mol,即相当于对原平衡加压,平衡向正反应方向移动,气体的平均相对分子质量会增大,故答案为:增大;
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1mol,相当于体积增大到原来的2倍,平衡不移动,气体的密度也不变,故答案为:不变.
点评 本题主要考查影响化学平衡的因素,转化率的比较,等效平衡的思想,解题中主要注意平衡思想的运用.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+一定不存在 | |
| B. | 该溶液中含CO32-离子的浓度为0.1 mol/L | |
| C. | Cl-可能存在 | |
| D. | Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$值增大 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10 mL pH=11的NaOH溶液,酸与碱恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.2mol | C. | 0.05mol | D. | 0.025mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可用作食品干燥剂 | |
| B. | 烧碱固体可用作食品干燥剂 | |
| C. | P2O5不可用作食品干燥剂 | |
| D. | 具有吸水性的植物纤维可用作食品干燥剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com