
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |

分析 (1)由题目信息可知,C与K2MnO4在硫酸条件下反应生成CO2、MnSO4、K2SO4与H2O,反应中K2MnO4中锰元素化合价降低4价,碳元素化合价升高4价,化合价升降最小公倍数为4,故K2MnO4前的系数是1,碳单质前的系数是1,再根据原子守恒配平;
(2)①根据氢气物质的量计算消耗水的物质的量,再计算平衡时水的物质的量,反应前后气体物质的量不变,则平衡时混合气体总物质的量为3mol,进而计算平衡时水的体积分数;
②可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量不变,由此衍生的其它一些物理量不变,判断平衡的物理量应随反应进行发生不变,该物理量由变化到不变化说明到达平衡;
③已知:Ⅰ.C(s)+H2O(g)=CO(g)+H2(g),令平衡常数为K1,
Ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g),令平衡常数为K2,
则Ⅱ-Ⅰ可得:CO(g)+H2O(g)?CO2(g)+H2(g),故该反应平衡常数K=$\frac{{K}_{2}}{{K}_{1}}$;
(3)已知:①.C(s)+O2(g)=CO2(g)△H 1=-393.5kJ•mol-1
②.CO2(g)+C(s)=2CO(g)△H 2=+172.5kJ•mol-1
③.S(s)+O2(g)=SO2(g)△H 3=-296.0kJ•mol-1
根据盖斯定律,①-②-③可得:2CO(g)+SO2(g)=S(s)+2CO2(g);
(4)某含有BaCO3沉淀的悬浊液中c(CO32-)=0.2mol/L,根据碳酸钡溶度积计算溶液中c(Ba2+),如果加入等体积的Na2SO4溶液,计算混合后溶液中c(Ba2+),如溶液中生成BaSO4沉淀,则应在混合液中满足c(Ba2+)×c(SO42-)>1×10-10,计算混合溶液转化硫酸根最小浓度,原硫酸钠溶液最小浓度为混合后溶液中硫酸根离子最小浓度2倍;
(5)A.CH3COOH溶液、CH3COONa溶液氢氧根离子均源于水的电离;
B.根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-);
C.溶液呈中性,再根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)判断;
D.溶液呈碱性,此时溶液中钠离子浓度为0.05mol/L,结合电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)判断;
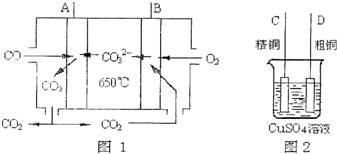
(6)①由图可知,A极CO发生氧化反应,CO失去电子与碳酸根离子结合生成二氧化碳;
②原电池中A为负极,B为正极,电解粗铜的精炼,粗铜作阳极,连接电源正极,精铜作阴极,连接电源负极.
解答 解:(1)由题目信息可知,C与K2MnO4在硫酸条件下反应生成CO2、MnSO4、K2SO4与H2O,反应中K2MnO4中锰元素化合价降低4价,碳元素化合价升高4价,化合价升降最小公倍数为4,故K2MnO4前的系数是1,碳单质前的系数是1,再根据原子守恒配平后反应方程式为:C+K2MnO4+2H2SO4=CO2↑+MnSO4+K2SO4+2H2O,
故答案为:C+K2MnO4+2H2SO4=CO2↑+MnSO4+K2SO4+2H2O;
(2)①实验2条件下平衡时生成氢气为0.4mol,由方程式可知消耗水为0.4mol,则平衡时水的物质的量为1mol-0.4mol=0.6mol,反应前后气体物质的量不变,则平衡时混合气体总物质的量为3mol,故平衡时水的体积分数为$\frac{0.6mol}{2mol}$×100%=20%,
故答案为:20%;
②a.单位时间内生成n mol H2的同时生成n mol CO,生成的氢气与消耗氢气相等,反应到达平衡,故a正确;
b.反应前后气体物质的量不变,恒温恒容下,容器内压强始终不变化,故b错误;
c.混合气体总质量不变,容器容积不变,混合气体密度为定值,故c错误;
d.混合气体总质量不变,反应前后气体物质的量不变,混合气体的平均相对分子质量始终不变,故d错误;
e.随反应进行二氧化碳质量增大,其质量分数增大,CO2的质量分数不再变化说明到达平衡,故e正确,
故选:ae;
③已知:Ⅰ.C(s)+H2O(g)=CO(g)+H2(g),令平衡常数为K1,
Ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g),令平衡常数为K2,
则Ⅱ-Ⅰ可得:CO(g)+H2O(g)?CO2(g)+H2(g),故该反应平衡常数K=$\frac{{K}_{2}}{{K}_{1}}$,故lgK=lgK2-lgK1=-0.03-(-0.39)=0.36,
故答案为:0.36;
(3)已知:①.C(s)+O2(g)=CO2(g)△H 1=-393.5kJ•mol-1
②.CO2(g)+C(s)=2CO(g)△H 2=+172.5kJ•mol-1
③.S(s)+O2(g)=SO2(g)△H 3=-296.0kJ•mol-1
根据盖斯定律,①-②-③可得:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1;
(4)某含有BaCO3沉淀的悬浊液中,c(CO32-)=0.2mol•L-1,溶液中c(Ba2+)=$\frac{8×1{0}^{-9}}{0.2}$mol/L=4×10-8mol/L,如果加入等体积的Na2SO4溶液,此时溶液中c(Ba2+)=2×10-8mol/L,如溶液中生成BaSO4沉淀,则应在混合液中满足c(Ba2+)×c(SO42-)>1×10-10,则c(SO42-)>$\frac{1×1{0}^{-10}}{2×1{0}^{-8}}$mol/L=5×10-3mol/L,则加入Na2SO4溶液的物质的量浓度最小是2×5×10-3mol/L=0.01mol/L.
故答案为:0.01;
(5)A.pH=3的CH3COOH溶液中氢氧根离子源于水电离,浓度为10-10mol/L,为pH=11的CH3COONa溶液中,氢氧根离子也源于水的电离,溶液中氢氧根离子浓度为10-3mol/L,故错误;
B.①点时pH=6,此时溶液中c(H+)=10-6mol/L,c(OH-)=10-8mol/L,由电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,故B正确;
C.②点时溶液pH=7,则c(H+)=c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故溶液中的c(CH3COO-)=c(Na+),故C正确;
D.③点时V=20mL,溶液呈碱性,则c(H+)<c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故溶液中的c(CH3COO-)<c(Na+),此时c(Na+)=0.05mol/L,故D错误,
故选:BC;
(6)①由图可知,A极CO发生氧化反应,CO失去电子与碳酸根离子结合生成二氧化碳,电极反应式为:CO-2e-+CO32-=2CO2 ,
故答案为:CO-2e-+CO32-=2CO2 ;
②原电池中A为负极,B为正极,电解粗铜的精炼,粗铜作阳极,连接电源正极,精铜作阴极,连接电源负极,故B极应该与D极相连,
故答案为:D.
点评 本题考查化学平衡计算与影响因素、平衡常数、平衡状态判断、氧化还原反应方程式配平、热化学方程式书写、离子浓度大小比较、溶度积有关计算、电化学等,是对学生综合能力的考查,需要学生具备扎实的基础难度中等.


科目:高中化学 来源: 题型:解答题
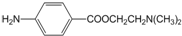 )的三条合成路线如图所示(部分反应试剂和条件已省略):
)的三条合成路线如图所示(部分反应试剂和条件已省略):
 ;C中官能团的名称是氨基和羧基.
;C中官能团的名称是氨基和羧基. ;1mol该物质与NaOH溶液共热最多消耗2mol NaOH.
;1mol该物质与NaOH溶液共热最多消耗2mol NaOH.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-和Cl2均有毒 | B. | Cl-和Cl2均呈黄绿色 | ||
| C. | 相比较,Cl-稳定,Cl2活泼 | D. | Cl-和Cl2均能与金属单质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
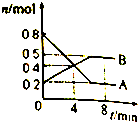 某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,
某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
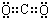
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在放热反应中,旧键断裂需要的能量比新键形成放出的能量多 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 一个化学反应的能量变化只与反应物的用量有关,与各物质的状态无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com