
| A. | 2Fe3++Cu═2Fe2++Cu2+ | B. | Zn+2H+═Zn2++H2↑ | ||
| C. | 2H2+O2═2H2O | D. | H++OH-═H2O |
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
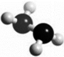 肼(N2H4)是火箭燃料,常温下为液体,其分子的球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.下列说法正确的是( )
肼(N2H4)是火箭燃料,常温下为液体,其分子的球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.下列说法正确的是( )| A. | 标准状况下,11.2L N2H4中含共用电子对数为2.5NA | |
| B. | 1mol N2H4和1mol H2O2含有的电子总数不相等 | |
| C. | 若生成3.6g H2O,则上述反应转移电子的数目为0.2 NA | |
| D. | N2H4和H2O2均只含有极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶液导电的一定是分子晶体 | B. | 熔融态导电的一定是离子晶体 | ||
| C. | 原子晶体固态一定不导电 | D. | 分子晶体熔融态一定不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 1-己醇的沸点比己烷的沸点高89℃ | 1-己醇和己烷可通过蒸馏初步分离 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | H2SO4是离子化合物 | 硫酸溶液可导电 |
| D | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X元素可以组成多种单质 | |
| B. | Y和Z可能在同一周期 | |
| C. | X与W形成的化合物和Z与W形成的化合物的化学键类型不同 | |
| D. | 元素X、Y、W的最高价氧化物对应水化物的酸性强弱:X<Y<W |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 能使潮湿的有色布条褪色 | |
| B. | 钠在氯气中燃烧,生成白色的烟 | |
| C. | 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色烟雾 | |
| D. | 氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com