
����Ŀ��ij�����Һ�п��ܺ���HCl��MgCl2��AlCl3��NH4Cl��Na2CO3��KCl�еļ������ʣ�������Һ����μ���NaOH��Һ���������������ʵ���(n)������NaOH��Һ���(V)�Ĺ�ϵ��ͼ��ʾ���ش��������⣺

��1����Һ��һ�����е�������______________���ѧʽ����
��2����Һ��һ�������е�������____________���ѧʽ����
��3����Һ�п��ܺ��е�������__________�������ƣ����жϸ������Ƿ���ڵ�ʵ�鷽����________��������_____________��
��4���ֱ�д��AB�Ρ�BC�η��������ӷ���ʽ��
��AB��Ϊ________________________________��
��BC��Ϊ________________________________��
���𰸡���1��HCl��AlCl3��NH4Cl
��2��MgCl2��Na2CO3
��3���Ȼ��� ��ɫ��Ӧ ����ɫ�ܲ����۲���ɫ��Ӧ�Ƿ�Ϊ��ɫ
��4����Al3����3OH��===Al(OH)3�� ��NH4+��OH��=NH3��H2O
��������
���������OA����NaOH��Һ�к�HCl���������NaOH��Һ������ȫ���ܽ⣬˵����MgCl2�����Գ���ֻ��Al(OH)3��BC����NaOH��Һ��NH4Cl��Ӧ����ԭ��Һ��һ������HCl��AlCl3��NH4Cl��һ����MgCl2������ΪAlCl3��HCl��Na2CO3���ܴ������棬����һ����Na2CO3�����ܺ���KCl�� ������ɫ��Ӧ����ȷ������1����Һ��һ�����е�������HCl��AlCl3��NH4Cl��
��2����Һ��һ�������е�������MgCl2��Na2CO3��
��3����Һ�п��ܺ��е��������Ȼ������жϸ������Ƿ���ڵ�ʵ�鷽������ɫ��Ӧ������������ɫ�ܲ����۲���ɫ��Ӧ�Ƿ�Ϊ��ɫ��
��4��AB�Ρ�BC�η��������ӷ���ʽ����AB��ΪAl3����3OH��===Al(OH)3����
��BC��ΪNH4+��OH��=NH3��H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⡢������Ԫ����ɵij���������H2O��H2O2��������һ�������¾��ɷֽ⡣
��1����֪��
��ѧ�� | �Ͽ�1mol��ѧ�������������kJ�� |
H-H | 436 |
O-H | 463 |
O=O | 498 |
��H2O�ĵ���ʽ��________________��
��H2O(g)�ֽ���Ȼ�ѧ����ʽ��________________________��
��11.2 L����״������H2��ȫȼ�գ�������̬ˮ���ų�__________kJ��������
��2��ijͬѧ��H2O2�ֽ�Ϊ����̽��Ũ������Һ����ԶԷ�Ӧ���ʵ�Ӱ���������£����������ʾ�ķ������ʵ����
ʵ���� | ��Ӧ�� | ���� | |
a | 50 mL5%H2O2��Һ | 1 mL0.1 mol��L-1FeCl3��Һ | |
b | 50 mL5%H2O2��Һ | ����Ũ���� | 1 mL0.1 mol��L-1FeCl3��Һ |
c | 50 mL5%H2O2��Һ | ����ŨNaOH��Һ | 1 mL 0.1 mol��L-1FeCl3��Һ |
d | 50 mL5%H2O2��Һ | MnO2 | |
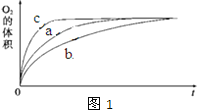
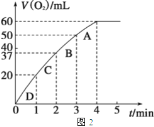
�� ���ʵ��a��b��c�����������������ʱ��仯�Ĺ�ϵ��ͼ1��ʾ���ɸ�ͼ�ܹ��ó���ʵ�������______________________��
�� ���ʵ��d�ڱ�״���·ų������������ʱ��仯�Ĺ�ϵ��ͼ2��ʾ�����ͷ�Ӧ���ʱ仯��ԭ��________________������H2O2�ij�ʼ���ʵ���Ũ��Ϊ________________ (������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ոմ�ũҵѧԺ��ҵ��С������������ѧ��֪ʶ��ũ����������ࡣ�����Ƶ�����Һ�к���Mg2+��K+��Ca2+��Zn2+����Ũ�ȶ���0��1molL��1������һ��ʱ�������Һ��ʣ�������ǣ� ��
A. Ca2+ B. Mg2+ C. K+ D. Zn2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ�����������ʢװ��Ũ���ᡣΪ�о����ʲ�������Ũ����ķ�Ӧ��ijѧϰС�����������̽�����
��̽��һ��
��1����ͬѧ����ȥ�������������������̼�ظ֣�������Ũ�����У�10���Ӻ���������ͭ��Һ�У�Ƭ�̺�ȡ���۲죬�������������Ա仯����ԭ����____________________��
��̽������
��2������ȡ����6.0 g����15.0 mLŨ�����У����ȣ���ַ�Ӧ��õ���ҺX���ռ�������Y����ͬѧȡ336 mL����״��������Yͨ��������ˮ�У�������Ӧ��SO2��Br2��2H2O===2HBr��H2SO4Ȼ���������BaCl2��Һ�����ʵ�������ø������2.33 g���ɴ���֪����Y��SO2���������Ϊ________��
��������ʵ����SO2��������Ľ������ͬѧ��Ϊ����Y�л����ܺ���H2��Q���塣Ϊ�����������̽��ʵ��װ�ã�ͼ�мг�����ʡ�ԣ���
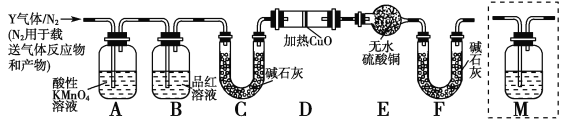
��3��װ��B���Լ���������________��
��4����Ϊ����Y�л�����Q��������_____________________���û�ѧ����ʽ��ʾ����
��5��Ϊȷ��Q�Ĵ��ڣ�����װ��������M��________��ѡ����ţ���
a��A֮ǰ b��A��B�� c��B��C�� d��C��D��
��6���������Y�к���H2��Ԥ��ʵ������Ӧ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����Ʒ�к�������������Na2SO4�����������̽��о��������������еģ� ����д�Ϻ��ʵ��Լ����ڣ� ����д��ʵ��������ơ�д���йط�Ӧ�Ļ�ѧ����ʽ��
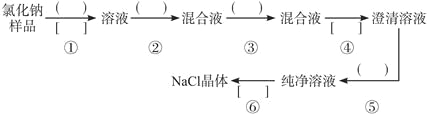
��1������������������������������Լ��ֱ�Ϊ________��_________��_________��________��
��2�����������������IJ������Ʒֱ�Ϊ_________��_________��_________��
��3��д���йصĻ�ѧ����ʽ��
��������_____________________________��
��������_____________________________��
��4�����������õ��IJ���������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC2H6O �Ŀ����Ǽ��ѻ��Ҵ����ɲ��û�ѧ�����������������Լ������м����в��ܶԶ��߽��м������
A. ���ý����ƻ��߽����� B. ����ȼ�շ�
C. ���ú������ D. ���ú˴Ź�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ȷ�Ӧ2CO��g�� = 2C��s����O2��g�� ������H ����S�����¶ȶ��䣬����˵������ȷ����
A. ���������Է����� B. ���������Է�����
C. �κ��¶��¶����Է����� D. �κ��¶��¶������Է�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�������HCl���壬��������100mLϡ�����У�������Һ��������䣬������Һ�м���4molL��1��NaOH��Һ10mLǡ�ó����ԣ�����������������Һ�е��������Ba(OH)2 ��Һ�����ó�������Ϊ2.33g��
��1�����ɳ����Ļ�ѧ����ʽΪ_________________________��
��2����������ʵ���Ũ�ȣ�![]() =____________________________��
=____________________________��
��3����HCl�����ڱ�״���µ����Ϊ_____________mL��
��4������û�����Һ����Ϊ100mL���м���Na2CO310H2O���壬ֱ�����ٲ�������ʱΪֹ������Na2CO310H2O���������Ϊ____________g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й���������
(��֪N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g) ![]() kJ��mol
kJ��mol![]() )
)
���� | �� | �� | �� |
��Ӧ��Ͷ���� | 1mol N2��3mol H2 | 2mol NH3 | 4mol NH3 |
NH3��Ũ��(mol/L) | c1 | c2 | c3 |
��Ӧ�������仯 | �ų�akJ | ����bkJ | ����ckJ |
��ϵѹǿ(pa) | p1 | p2 | p3 |
��Ӧ��ת���� | ��1 | ��2 | ��3 |
��д�������������Ĺ�ϵ��
��1��Ũ��c1��c2__________________2c2��c3 ________________
��2������a��b __________________2b��c___________________
��3��ѹǿp1��p2_________________2p2��p3 __________________
��4��ת������1����2_________________��2����3___________________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com