
【题目】
深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C
2(CN)2↑+12KCN+N2↑+Fe3C+C
请回答下列问题:
(1)①Fe2+基态核外电子排布式为_____。
②![]() 的空间构型为______(用文字描述)。
的空间构型为______(用文字描述)。
③(CN)2分子中碳原子杂化轨道类型为_______,一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____(填晶体类型)。
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则该立方体是不是Fe3O4的晶胞______(填“是”或“否”),立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。

(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
【答案】1s22s22p63s23p63d6或[Ar]3d6 三角锥形 sp ![]() 或
或![]() 12 5 分子晶体 是 正八面体 x=
12 5 分子晶体 是 正八面体 x=![]()
【解析】
(1)①铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理写出Fe2+基态离子核外电子排布式;
②三角锥形,根据价层电子对互斥理论,它本来是正四面体形的,但是有一对孤电子对要排斥它,据此解答;
③原子数相同,电子总数相同的分子,互称为等电子体,等电子体的结构相似;
(2)配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;分子晶体的熔沸点较低;
(3)由图示可知晶体中的氧离子构成面心立方最密堆积,该立方体中氧离子数目为12×1/4+1=4,Fe3+的数目为4×1/8+3×1/2=2,Fe2+的数目为1,则Fe和O的原子数目为3:4,是Fe3O4的晶胞;立方体中三价铁离子周围有6个氧离子围成的正八面体空隙中心;
(4)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“FexO”,再根据m=ρV计算。
(1)①铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变为Fe2+,根据构造原理知,该离子核外电子排布式为[Ar]3d6。本小题答案为:1s22s22p63s23p63d6 或[Ar]3d6。
②三角锥形,根据价层电子对互斥理论,它本来是正四面体形的,但是有一对孤电子对要排斥它,就形成三角锥形。本小题答案为:三角锥形。
③(CN)2分子的分子结构为![]() ,碳原子采取sp杂化;与CN-互为等电子体的分子有CO或N2,电子式为
,碳原子采取sp杂化;与CN-互为等电子体的分子有CO或N2,电子式为![]() 或
或![]() 。本小题答案为:sp;
。本小题答案为:sp;![]() 或
或![]() 。
。
(2)配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,分子晶体的熔沸点较低,根据题中所给信息可知,该物质的熔沸点较低,所以为分子晶体。本小题答案为:5;分子晶体。
(3)由图示可知晶体中的氧离子构成面心立方最密堆积,该立方体中氧离子数目为12×1/4+1=4,Fe3+的数目为4×1/8+3×1/2=2,Fe2+的数目为1,则Fe和O的原子数目为3:4,是Fe3O4的晶胞;立方体中三价铁离子周围有6个氧离子围成的正八面体空隙中心。本小题答案为:是;正八面体。
(4)FexO晶体的晶胞结构为NaCl型,所以每个晶胞中含有4个O原子,有4个“FexO”,再根据m=ρV可知:4×(56x+16)/NAg=5.71gcm3×(4.28×108cm)3,解得:x=![]() 。本小答案为:x=
。本小答案为:x=![]() 。
。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热。下图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)装置B的作用是______ ,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:_______。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入______ (选“a”“b”或“c”)
a | b | c | |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E 的目的是为了比较Cl2、Br2、I2的氧化性强弱.已知Br2的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶于苯,且I2的苯溶液为紫红色.当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2,请写出D中对应的离子方程式并用单线桥法表示出电子转移情况:_________ 。打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象______ (填“能”或“不能”)说明 Br2的氧化性大于I2。
(4)装置F的作用是除去污染性的物质(Cl2、Br2等),已知 Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且 值与温度高低有关.若烧杯中装有500mL 0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
值与温度高低有关.若烧杯中装有500mL 0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的每一个方格表示有关的一种反应物或生成物,其中A、C为无色气体
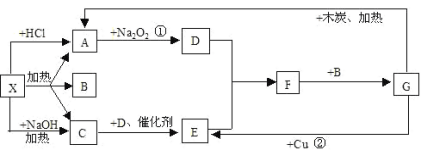
(1)写出有关物质的化学式X:_______;F_______
(2)写出A→D的化学方程式____________
(3)写出实验室制备C的化学方程式_______
(4)C可用于制备尿素,尿素CO(NH2)2适用于各种土壤,在土壤中尿素发生水解,生成两种气体,其水解的化学方程式是______
(5)分别取两份50mLNaOH溶液,各向其中通入一定量的气体A,随后各取溶液10mL分别将其稀释到相同体积,得到溶液甲和乙,分别向甲和乙中逐滴加入0.1mol/L的HCl溶液,产生的A气体体积(标准状况下)与所加入的HCl的体积之间的关系如图所示,试
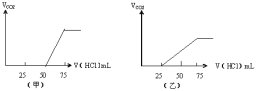
①NaOH在吸收A气体后,乙图所示溶液中存在的溶质是:_____,其物质的量之比是:_________
②原NaOH溶液的物质的量浓度是_______mol/L,甲图所示溶液最多还能吸收A体积为_____mL(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出方程式。
(1)铁和稀硫酸(写出离子方程式)___;
(2)氢氧化钡溶液和稀硫酸(写出离子方程式)__;
(3)氧化铜和稀盐酸(写出离子方程式)__;
(4)制备氢氧化铁胶体(写出对应的化学方程式)___;
(5)CO32-+2H+=CO2↑+H2O(写出对应的化学方程式)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于提纯或分离物质的方法有:A、萃取分液 B、加热分解 C、蒸发结晶 D、分液 E、蒸馏 F、过滤 G、渗析等,请将提纯或分离的序号填在后面横线上。
(1)分离饱和食盐水与泥沙的混合物___,
(2)精制Fe(OH)3胶体![]() 含有NaCl溶液
含有NaCl溶液![]() ___,
___,
(3)分离相溶的CCl4(沸点为76.75℃)和甲苯(110.6℃)的混合物___,
(4)从碘水里提取碘____。
查看答案和解析>>
科目:高中化学 来源: 题型:
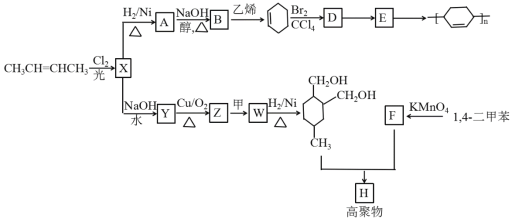
【题目】以烯烃为原料,合成某些高聚物的路线如下:
已知:Ⅰ.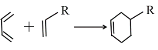 (R代表取代基或氢);
(R代表取代基或氢);
Ⅱ.甲为烃;Ⅲ.F能与NaHCO3反应产生CO2;请完成以下问题:
(1)CH3CH=CHCH3的名称是_________,X中官能团的名称是______________。
(2)A→B的化学方程式是________________________________________。
(3)D→E的反应类型为:______。
(4)下列有关说法正确的是_________。
a.有机物Y与HOCH2CH2OH互为同系物
b.有机物Z能发生银镜反应
c.有机物Y的沸点比B低
d.有机物F能与己二胺缩聚成聚合物
(5)写出Z→W的化学方程式:____________________。
(6)Y的同分异构体中,含有酯基的有______种。
(7)高聚物H的结构简式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 向含0. 1 mol Na2SiO3的溶液中滴加盐酸,生成的H2SiO3胶体中胶粒的数目为0.1NA
B. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
C. 常温下,1L pH=10的氨水溶液中,发生电离的水分子数为1×10-10 NA
D. 7.8gNa2O2分别与过量的CO2和过量的SO2充分反应,转移的电子数目均为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200 mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol·L-1的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。
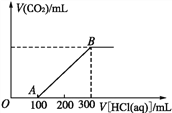
(1)OA段、AB段发生反应的离子方程式为_________________、__________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com