
【题目】利用电溶氧化法从低品位钼矿中回收铼(Re),其原理如图所示,下列说法正确的是
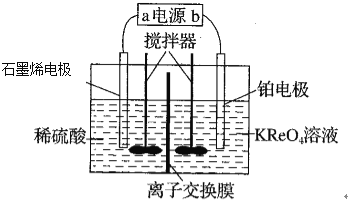
A.阴极材料选用石墨烯增大了接触面积
B.上图装罝中的离子交换膜为阴离子交换膜
C.铂电极反应式为8H++ReO4-+7e-=Re+4H2O
D.有0.4mole-转移时,石墨烯上产生0.2mo1H2
【答案】C
【解析】
根据题意,利用电溶氧化法从低品位钼矿中回收铼(Re),因此右侧ReO4-得到电子,发生还原反应,铂电极为阴极,电极方程式为ReO4-+7e-+8H+=Re+4H2O;而石墨烯电极为阳极,稀硫酸中的H2O失去电子,生成O2,电极方程式为2H2O-4e-=4H++O2↑。
A.选用石墨烯,可以增大接触面积,但是根据分析,石墨烯电极为电解池的阳极,而不是阴极,A错误;
B.在电解池的右侧,ReO4-得到电子生成Re,电极方程式为ReO4-+7e-+8H+=Re+4H2O;电解池的左侧,稀硫酸中的H2O失去电子,电极方程式为2H2O-4e-=4H++O2↑,左侧生成的H+,经过离子交换膜到达右侧被消耗;右侧溶液中的K+也需要移动到左侧,与SO42-结合,因此该离子交换膜为阳离子交换膜,B错误;
C.根据分析,铂电极为阴极,ReO4-得到电子生成Re,发生还原反应,电极方程式为ReO4-+7e-+8H+=Re+4H2O,C正确;
D.根据分析,石墨烯电极为阳极,稀硫酸中的H2O失去电子,生成O2,电极方程式为2H2O-4e-=4H++O2↑,不产生H2,D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】如图中,A是氯气的发生装置,B、C是净化气体的装置,B装置中装有饱和食盐水,D中装铁丝网;反应后E的底部有棕色固体聚集;F是碱液用于吸收多余气体的装置。
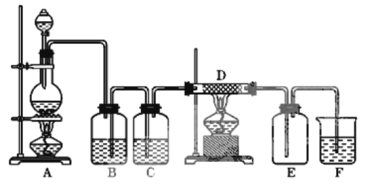
(1)上述装置中有一处错误,请指出是___处(用字母表示)。
(2)B装置的作用是___,C装置中需要加入___。
(3)写出A中发生反应的化学方程式___。
(4)如果A中产生氯气2.24L(标准状况),则被氧化的HCl的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量比为14 :15的N2和NO混合,则混合气体中氮原子和氧原子的个数比为________
(2)同温同压下,质量相同的五种气体:①CO2 ②H2 ③O2 ④CH4 ⑤SO2所占的体积由大到小的顺序是(填序号,下同)_________________;
(3)已知19g某二价金属的氯化物RCl2中含有0.4mol的Cl-离子,则R的相对原子质量为______________________ ;
(4)在Al2(SO4)3和MgSO4组成的混合物中,Al3+与Mg2+的物质的量之比为2∶1,则在含有2mol SO42-的混合物中,MgSO4的质量是________________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO═Fe(CO)5。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3═Cu(NH3)3(CO)OOCCH3。回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最低的是__(填字母序号)。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(2)写出CO的一种常见等电子体的结构式:___;C、N、O的第一电离能由大到小的顺序为__(用元素符号表示)。
(3)与O同族的元素还有S、Se、Te,它们氢化物的沸点大小为H2O>H2Te>H2Se>H2S,其原因是___。
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价,1mol[Cu(NH3)2]+中含有σ键的数目___。则其中碳原子的杂化轨道类型是__,NH3分子的价电子对互斥理论模型是___。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:
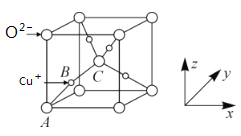
①若坐标参数A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C的坐标参数为__;
),则C的坐标参数为__;
②若阿伏加德罗常数为NA,该晶胞的边长为apm,则晶体的密度为___gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
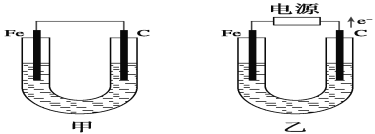
(1)若两池中电解质溶液均为CuSO4溶液,则反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是__________________________________。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式_______________________________。
②甲池中碳极上电极反应式是____________________________,乙池碳极上电极反应属于______________(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为________________________________________。
④若乙池转移0.02 mol e-后停止实验,池中电解质溶液体积是200 mL,则溶液混合均匀后的c(OH—)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟工业制硝酸原理的实验装置。先用酒精灯对硬质玻璃管里的三氧化二铬加热,然后把空气鼓入盛有浓氨水的锥形瓶,当三氧化二铬保持红热状态时,移去酒精灯。根据题意回答问题:

(1)硬质玻璃管里发生反应的化学方程式为______。当三氧化二铬红热时,要移去酒精灯,原因是:______。
(2)圆底烧瓶里的实验现象是______,鼓入空气的作用是______。
(3)实验过程中,如果慢慢地鼓入空气,石蕊溶液的颜色______。
(4)实验结束后,在圆底烧瓶内壁上有时会看到少量无色晶体,写出生成该晶体的化学方程式:______。
(5)工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁或浓硫酸,然后______(填一种操作名称)。
(6)实验室里保存浓硝酸要用棕色瓶的原因是__________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物,其中B、C、D 焰色反应均为黄色,而A的焰色反应为紫色,B、D和盐酸反应均得到C,将固体B加热分解可得到D,若在D的溶液中通入一种无色无味气体,又可得到B的溶液;若A的溶液滴加到FeCl2溶液中,先出现白色沉淀迅速变成灰绿色,最后变成红褐色沉淀E。
(1)试推断各物质的化学式:
A:___ B:___ C:___
(2)按要求写出下列方程式:
①D与盐酸反应的离子方程式:___;
②E固体受热分解的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2Na2CO3+SnO2+4S![]() Na2SO4+Na2SnS3+2CO2↑。回答下列问题:
Na2SO4+Na2SnS3+2CO2↑。回答下列问题:
(1)上述反应涉及的元素中,非金属性最强的元素的最外层电子排布式为_____________,在上述反应的生成物中,属于分子晶体的的电子式__________。
(2)反应中单质物质的原子核外共有______种不同形状的电子云,该原子最外层电子的能量 ______上述方程式中同主族的另一元素原子的最外层电子能量(选填“高于”“低于”或“等于”)。
(3)上述反应中,金属性最强的元素与铝元素相比较,可作为判断金属性强弱依据的是___(选填编号)。
a.能否置换出铝盐溶液中铝
b.Al(OH)3能否溶解在该元素最高价氧化物对应水化物中
c.单质与氢气化合的难易程度
d.单质与同浓度的稀盐酸发生反应的快慢程度
(4)常温下,Na2CO3溶液比Na2SO4溶液碱性______(选填“强”或“弱”)用离子方程式说明原因:__________________。(选填“冷”或“热”)的纯碱水易于除油污,简要说明原因:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此判断:
(1)写出KAl(SO4)2的电离方程式:____________。
(2)A混合物溶于水所得到的沉淀是_________________,往该沉淀中加入NaOH溶液所发生反应的化学方程式为_________________。
(3)写出反应②的化学方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com