
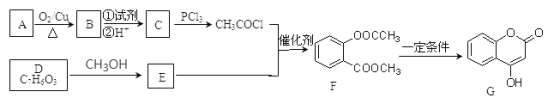
【题目】化合物G是一种医药中间体,常用于制备抗凝血药。可以通过如图所示的路线合成:
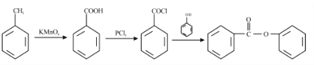
已知:①RCOOH![]() RCOCl;②D与FeCl3溶液能发生显色反应。
RCOCl;②D与FeCl3溶液能发生显色反应。
③:![]()
回答下列问题:
(1)C→H的反应类型是_______________,B→C步骤①中所加的试剂可能是_____________,D中的官能团名称为____________________。
(2)B、E的结构简式为:B:_____________,E:______________。
(3)A→B的化学方程式为_________________,G与足量NaOH溶液充分反应的化学方程式为_________________________。
(4)写出同时满足下列条件的所有E的同分异构体的结构简式________________。
①不能发生水解反应,能发生银镜反应
②该分子核磁共振氢谱有五个组峰,且峰面积之比为2:2:2:1:1
③与FeCl3溶液能发生显色反应
④苯环上有两种不同化学环境的氢原子
(5)已知:酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(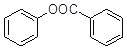 )是一种重要的有机合成中间体。试结合题中信息写出以苯酚、甲苯为原料制取该化合物合成路线流程图(其他试剂任选)______。合成路线流程图示例:
)是一种重要的有机合成中间体。试结合题中信息写出以苯酚、甲苯为原料制取该化合物合成路线流程图(其他试剂任选)______。合成路线流程图示例:
【答案】 取代反应 银氨溶液或新制Cu(OH)2悬溶液 羟基、羧基 CH3CHO 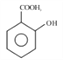 2CH3CH2OH+O2
2CH3CH2OH+O2![]() CH3CHO+2H2O
CH3CHO+2H2O 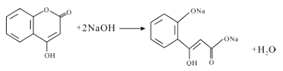
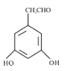


【解析】根据题中各物转化关系,结合信息RCOOH→PCl3RCOCl,可知C为CH3COOH,由A→B→C的转化条件可知,A被氧化成B,B再被氧化成C,所以B为CH3CHO,A为CH3CH2OH,根据F的结构可知E发生取代反应生成F,所以E为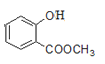 ,根据D的分子式和E的结构可知,D与甲醇反应生成E,所以D的结构简式为
,根据D的分子式和E的结构可知,D与甲醇反应生成E,所以D的结构简式为![]() ;B→C的转化是醛基氧化成羧基。
;B→C的转化是醛基氧化成羧基。
(1)B→C的转化是醛基氧化成羧基,所以所加的试剂可能是银氨溶液或新制氢氧化铜悬浊液,根据上面的分析可知,C+E→F的反应类型是取代反应;D中的官能团为羟基、羧基;
(2) 根据上面的分析可知,B和E的结构简式为CH3CHO 和 ;
;
(3)2CH3CH2OH+O2![]() CH3CHO+2H2O
CH3CHO+2H2O 
(4)①不能发生水解反应,能发生银镜反应说明有醛基,②该分子核磁共振氢谱有五个组峰,且峰面积之比为2:2:2:1:1说明不同位置的H有5种,③与FeCl3溶液能发生显色反应,说明有酚羟基,④苯环上有两种不同化学环境的氢原子,故结构简式为: 


(5)根据所提供的两种原料和合成产物苯甲酸苯酚酯的结构,并结合已知信息“RCOOH→PCl3RCOCl”可以得到合成路线流程图为: 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知化合物B是一种红棕色粉末,单质A和单质D是生活中常见的两种金属。它们在一定条件下按下图所示发生转化:

请回答:
(1)上述反应①②③④中属于氧化还原反应的是______________(填写序号)。
(2)写出下列物质化学式:B______,E______,F___________;
(3)将足量的CO2通入E溶液中,离子方程式是_____________________。
(4)H在空气中很容易被氧化成I,该过程的现象是___________________,该反应过程的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100 g质量分数为46%的乙醇(C2H6O)水溶液中含有的氧原子数为4NA
B. 2 mol Cu与100 mL浓度为18.4 mol·L1的浓硫酸在加热条件下充分反应,生成SO2分子数为0.92NA
C. 0.1 mol Fe在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA
D. 0.1 mol/L的Ba(OH)2溶液中,OH的个数为0.2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铁的化合物在工业生产和日常生活中都有广泛的用途。请回答下列问题:
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:________________________________。
铁锈的主要成分是____________(填写化学式),将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:_____________________。
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
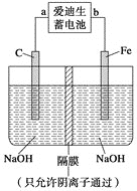
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是__________。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式__________________________。
③你认为高铁酸钠作为一种新型净水剂的理由可能是______。
A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明稀硝酸与铜反应产物中气体为NO,设计右下图实验(实验过程中活塞2为打开状态),下列说法中不正确的是
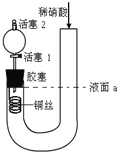
A. 关闭活塞1,加入稀硝酸至液面a处
B. 在装置左侧稍加热可以加速铜的溶解
C. 通过关闭或开启活塞1可以控制反应的进行
D. 反应开始后,胶塞下方有无色气体生成,但不能证明该气体为NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温、常压下,取下列四种气态烃各1 mol,分别在足量的氧气中燃烧,消耗氧气最多的是( )
A.CH4B.C3H8C.C4H10D.C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按纯净物、混合物、盐、氧化物的顺序组合的一组为( )。
A.盐酸、空气、氯化钠、熟石灰B.自来水、氨水、碳酸氢钠、二氧化硫
C.胆矾、盐酸、纯碱、干冰D.硫酸、水煤气、氯化铜溶液、五氧化二磷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-浓度最大的 ( )
A.200mL 2mol/L MgCl2溶液B.1000mL 2.5mol/L NaCl溶液
C.250mL 1mol/L AlCl3溶液D.200mL 4.5mol/L KClO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中均既有离子键又有共价键的一组是
A.NaOH、H2O、NH4ClB.KOH、Na2O2、NH4Cl
C.MgO、CaBr2、NaClD.Na2S、HCl、MgCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com