
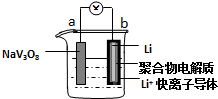
| A. | 放电时,该电池的总反应为:xLi+NaV3O8═NaLixV3O8 | |
| B. | 充电过程中Li+从阳极向阴极迁移 | |
| C. | 充电过程中阳极的电极反应式为NaLixV3O8-xe-═NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化 | |
| D. | 该电池可以用硫酸钠溶液作电解质 |
分析 放电时,b电极Li作负极,电极反应式为Li-e-═Li+,a作正极,电极反应式为NaV3O8+xLi++xe-=NaLixV3O8,则电池反应式为NaV3O8+xLi=NaLixV3O8,充电时,阴极、阳极电极反应式与负极、正极反应式正好相反,充电时,阳离子向阴极移动、阴离子向阳极移动,据此分析解答.
解答 解:放电时,b电极Li作负极,Li失电子发生氧化反应,电极反应式为Li-e-═Li+,a作正极,电极反应式为NaV3O8+xLi++xe-=NaLixV3O8,则电池反应式为NaV3O8+xLi=NaLixV3O8,故A正确;
B.充电时,阳离子向阴极移动、阴离子向阳极移动,所以Li+从阳极向阴极迁移,故B正确;
C.充电时,阴极、阳极电极反应式与负极、正极反应式正好相反,所以阳极的电极反应式为NaLixV3O8-xe-=NaV3O8+xLi+,NaLixV3O8中Na、O、Li元素化合价不变,则钒的化合价发生变化,失电子发生氧化反应,故C正确;
D.Li极易和水反应生成LiOH和氢气,所以电池中不可以用硫酸钠溶液作电解质溶液,故D错误;
故选D.
点评 本题考查化学电源新型电池,为高考高频点,明确原电池和电解池原理是解本题关键,难点是电极反应式的书写,知道物质的性质,题目难度中等.


科目:高中化学 来源: 题型:解答题
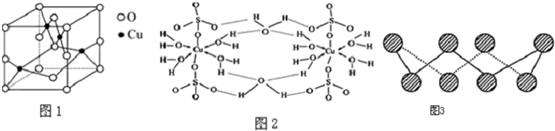
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
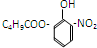 满足的有机物,下列描述中正确的是( )
满足的有机物,下列描述中正确的是( )| A. | 分子中有2种含氧官能团 | B. | 能发生取代、加成、消去、氧化反应 | ||
| C. | 1mol该有机物最多消耗3mol NaOH | D. | 苯环上的一溴代物最多有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )
如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )| A. | 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L (标准状况) | |
| B. | NO2转化为N2O4的转化率为20% | |
| C. | 容器甲中NO已反应完 | |
| D. | 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)钠镁铝三种元素中第一电离能最大的是Mg.
(1)钠镁铝三种元素中第一电离能最大的是Mg.| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1[ | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
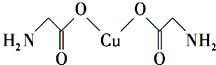
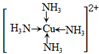 (标出配位键);
(标出配位键);查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{KMnO_{4}/H+}{→}$RCOOH+
$\stackrel{KMnO_{4}/H+}{→}$RCOOH+
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O
+H2O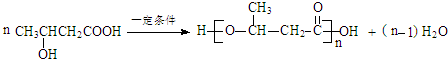 .
. .
.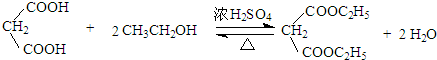 .
.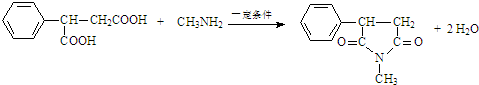 .
.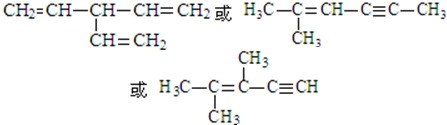 (写出一种即可).
(写出一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳化钙(CaC2)的电子式:Ca2+[:C::C:]2- | |
| B. | ${\;}_{8}^{18}$O2-离子的结构示意图: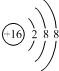 | |
| C. | 2-甲基-2-丙醇的结构简式: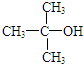 | |
| D. | Na2S水解的离子方程式:S2-+2H2O?2H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③④ | C. | ③④⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加水稀释,电离平衡正向移动,溶液中n(H+)减小 | |
| B. | 加热,电离平衡正向移动,溶液中c(CH3COO-)增大 | |
| C. | 通入少量HCl气体,电离平衡逆向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,电离平衡逆向移动,溶液中c(H+)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com