
【题目】科学家研制的一种使沙漠变绿洲的新技术,即在沙漠中喷洒一定量的聚丙烯酸酯(![]() )与水的混合物,使其与沙粒结合,既能阻止地下的盐分上升,又能拦截、蓄积雨水。下列对聚丙烯酸酯的叙述中正确的是( )
)与水的混合物,使其与沙粒结合,既能阻止地下的盐分上升,又能拦截、蓄积雨水。下列对聚丙烯酸酯的叙述中正确的是( )
①聚丙烯酸酯的单体的结构简式为CH2=CHCOOR
②聚丙烯酸酯没有固定的熔、沸点
③聚丙烯酸酯在一定条件下能发生水解反应和加成反应
④其聚合方式与酚醛树脂的聚合方式相同
A.①②B.③④C.①②③D.①②③④
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C是与植物生命活动密切相关的三种常见化合物,每种物质所含元素种类均不超过三种,甲是单质,有机物D也是生活中常见的物质,在一定条件下可发生如下反应:![]() 。它们之间有如图所示的转化关系:
。它们之间有如图所示的转化关系:
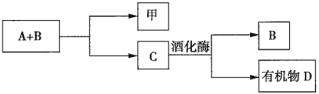
(1)在化合物A、B、C、D中所含元素种类完全相同的是________(填序号,下同)和________。
(2)在常温下,A和B通过________转化为C。该过程中________能转化为________能。
(3)写出由C生成D的化学方程式:________________。
(4)目前化合物B在大气中的含量呈上升趋势,其对环境造成的影响是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中用途广泛。回答下列问题:
(1)目前,低压甲醇铜基催化剂的主要组分是CuO、ZnO和Al2O3,下列氧原子电子排布图表示的状态中,能量最高的是__(填序号)。
A.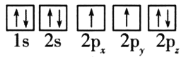 B.
B.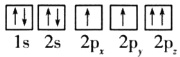
C.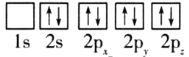 D.
D.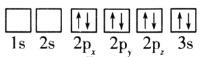
(2)铜离子是人体内多种酶的辅因子,某化合物与Cu+结合形成如图所示的离子。
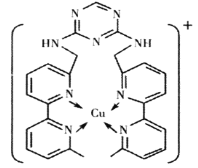
①该离子中含有化学键的类型有___(填序号)。
A.极性键 B.离子键 C.非极性键 D.配位键
②H、N、Cu三种元素的电负性由大到小的顺序是___。H、N、Cu三种元素形成单质其熔点由低到高顺序为___。
(3)某磷青铜晶胞结构如图所示:
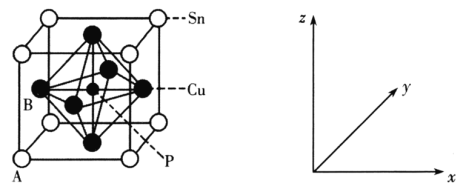
①其中原子坐标参数A为(0,0,0);B为(0,![]() ,
,![]() )。则P原子的坐标参数为___。
)。则P原子的坐标参数为___。
②该晶体中距离Cu原子最近的Sn原子有__个,这些Sn原子所呈现的构型为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业及国防工业上有广泛的用途。
(1)已知:
①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-1266.2k/mol
2N2(g)+6H2O(g) △H=-1266.2k/mol
②2H2(g)+O2(g)![]() 2H2O(g) △H=-483.6kJ/mol
2H2O(g) △H=-483.6kJ/mol
则合成氨反应N2(g)+3H2(g)![]() 2NH3(g) △H=___________kJ/mol,该反应属于___________。
2NH3(g) △H=___________kJ/mol,该反应属于___________。
A.高温自发 B.低温自发 C.恒自发 D.恒不自发
(2)在甲、乙、丙三个容积均为2L的密闭装置中,均充人4mol合成气,但N2、H2的投料比不同,在400℃时反应,测定N2的体积百分含量,得到下图一。
①乙装置中N2、H2的投料比为___________。
②反应达到平衡后,测得乙装置中H2的体积百分含量为25%,则400℃时,合成氨反应的平衡常数为___________(不须注明单位)。
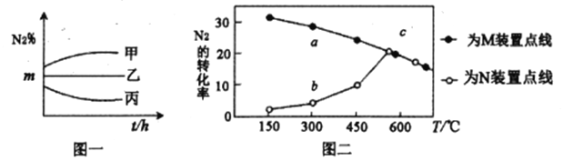
(3)在M、N两个装置中分别充入相同投料比的N2、H2,进行合成氨反应,各反应1小时,测定不同温度下N2的转化率,得到上图二。
①N2、H2在M、N两装置中反应时,不同的条件可能是______________________。
②在300℃时,a、b两点转化率差异的原因是______________________。
(4)氨法烟气脱硫技术渐趋成熟,回收SO2,并产出氮肥,其流程分两步:
①氨水吸收烟气中的SO2:xNH3+SO2(g)+H2O====(NH4)xH2-xSO3
②加入足量的磷酸得到纯净的SO2。写出该反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铝热反应的现象有如下描述:反应放出大量的热,并发出耀眼的光芒;纸漏斗的下部被烧穿,有熔融物落入沙中。已知![]() 、
、![]() 、
、![]() 、
、![]() 的熔点、沸点如表所示:
的熔点、沸点如表所示:
物质 |
|
|
|
|
熔点/℃ | 660 | 1565 | 2054 | 1535 |
沸点/℃ | 2467 | 3414 | 2980 | 2750 |
(1)某同学推测,铝热反应所得到的熔融物是铁铝合金,因为该反应放热能使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验,证明上述熔融物中含有金属铝,填写下列表格:
①所用试剂 | ______ |
②实验操作及现象 | ______ |
③有关反应的化学方程式 | ______ |
(3)欲在常温下溶解该熔融物,下列试剂中最好选用______(填序号),理由是_________________________。
a.浓硫酸 b.稀硫酸 c.硫酸锌溶液d. ![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为![]() ,还含有杂质
,还含有杂质![]() 和
和![]() )提取氧化铝并冶炼
)提取氧化铝并冶炼![]() 的操作过程如下:
的操作过程如下:
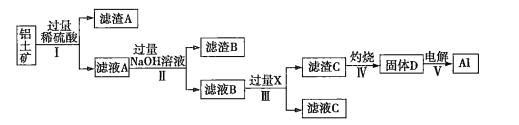
(1)滤渣A是______,滤渣B是__________。
(2)操作Ⅰ、Ⅱ、Ⅲ的名称是____________。
(3)生成滤渣C的离子方程式为___________________________________________。
(4)取100 mL滤液B,加入200mL 1.0 ![]() 的盐酸时,沉淀量达到最大且质量为11.7g。则滤液B中
的盐酸时,沉淀量达到最大且质量为11.7g。则滤液B中![]() ________,
________,![]() _______
_______ ![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下含成甲醇,发生的反应为:![]() ?
?![]() 已知CO、
已知CO、![]() 、
、![]() 的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则
的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则![]() ______。
______。![]() 在一容积为2L的恒容密闭容器中加入
在一容积为2L的恒容密闭容器中加入![]() CO和
CO和![]()
![]() ,发生如下反应:CO
,发生如下反应:CO![]() ,实验测得
,实验测得![]() 和
和![]() 下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
时间 | 10min | 20min | 30min | 40min | 50min | 60min |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]() 由上述数据可以判断:
由上述数据可以判断:![]() ______
______![]()
![]() 时,
时,![]() 的平均反应速率
的平均反应速率![]() ______。
______。![]() 该反应
该反应![]() 达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______
达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______![]() 选填编号
选填编号![]() 。
。
A 改用高效催化剂![]() 升高溫度
升高溫度![]() 缩小容器体积
缩小容器体积 ![]() 分离出甲醇
分离出甲醇 ![]() 增加CO的浓度
增加CO的浓度![]() 若保持
若保持![]() 不变,起始时加入CO、
不变,起始时加入CO、![]() 、
、![]() 的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。
的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。![]() 当反应在
当反应在![]() 达到20min时,控制体积不变,迅速将
达到20min时,控制体积不变,迅速将![]() ,
,![]() ,
,![]() 同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中
同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中![]() 浓度的变化趋势曲线:______
浓度的变化趋势曲线:______
![]() 在以
在以![]() 为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。
为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。![]() 燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比
燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在某杂志上发表研究报告称,利用铬同位素的系统分析发现,“古代大气氧含量高于现代水平的1%”。铬的同位素有![]() 、
、![]() 、
、![]() 、
、![]() 。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态![]() 的价层电子排布图为_________
的价层电子排布图为_________
(2)交警用“酒精仪”查酒驾,其化学反应原理如下:
2K2Cr2O7+3CH3CH2OH+8H2SO4→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O
①CH3CH2OH、CH3COOH的沸点高于对应的CH3OCH3(二甲醚)、HCOOCH3(甲酸甲酯),其主要原因是___________。
②CH3COOH分子中碳原子的杂化类型是______;CH3COOH分子中σ键和π键数目之比为_________。
③K2SO4晶体中阴离子的空间构型是________。上述反应中,只含极性键的极性分子有________(填分子式)。
(3)晶体铬的晶胞结构如图1所示,其堆积模型为___________;铬原子的配位数为___________。

(4)铬的一种氧化物晶胞结构如图2所示。六棱柱边长为a nm,高为b nm,NA代表阿伏加德罗常数的值。该晶体的化学式为______;该晶体的密度ρ=_______g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com