
【题目】硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中以废铁屑为原料来制备,步骤如下:
步骤1:将铁屑放入与铁不反应的洗涤剂去除铁表面的油污,分离出液体,洗净铁屑
步骤2:向处理过的铁屑中加入过量的稀硫酸 溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中的分离操作,所用到的玻璃仪器有____________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)为确认晶体中Fe2+在制备过程中没有被氧化,请你设计简单的实验方案进行验证(写出简单的实验过程、实验现象及结论)_______________________________________
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
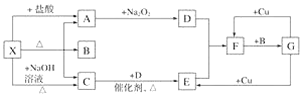
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在 Cu-ZnO-ZrO2 催化剂上CO2加氢制甲醇过程中水的作用机理,其主法错误的是

A.第①步中CO2和H2分子中都有化学键断裂
B.第③步的反应式为:*H3CO+H2O→CH3OH+*HO
C.第④步反应是一个放热过程
D.水在整个历程中可以循环使用,整个过程不消耗水也不产生水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象和结论或原因相符![]() 是( )
是( )
操作及现象 | 原因或结论 | |
A | 一块表面打磨过的铝箔在酒精灯上加热至熔化,液态铝不会滴落 | 铝的熔点高于三氧化二铝 |
B | 某溶液中先加入稀盐酸,再加入加入硝酸银产生白色沉淀 | 原溶液中一定含有Cl- |
C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无K+ |
D | 向氢氧化钠溶液中加入适量硫酸亚铁溶液,白色沉淀迅速变成灰绿色,最后变成红褐色 | 生成的氢氧化亚铁沉淀不稳定,容易被氧气氧化成氢氧化铁 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】广州大学附属东江中学“探源致善”化学兴趣小组采用下面的实验装置图制备纯净的氯气,根据相关知识填空:
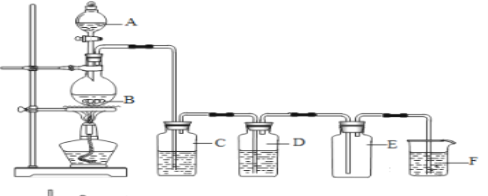
(1)A仪器的名称是_________________,B中发生的化学方程式为__________________________
(2)装置C中盛放的试剂是__________,装置F中的离子方程式为__________________________
(3)氯气溶于水制得氯水,请设计实验验证干燥的氯气无漂白性、新制的氯水具有酸性与漂白性(写出必要的实验步骤与实验现象)_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废铅蓄电池的回收中产生大量的铅膏,回收利用铅膏能有效减少铅污染,充分利用铅资源。
(1)铅膏制备PbO。铅膏经过预处理后(主要成分为PbSO4)加入Na2CO3溶液,使之转化为PbCO3,然后充分灼烧得到PbO。
①PbCO3分解产生aPbCO3bPbO中间产物。PbCO3和PbSO4加热升温过程中固体的质量变化见图1。PbCO3在300 ℃时分解的产物为_____________。
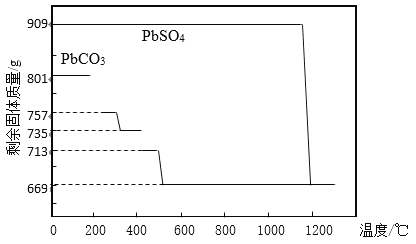
②工业上用PbCO3热分解制备的PbO而不直接热分解PbSO4制备的PbO的原因是_____________。
(2)沉淀除铅。铅膏经过转化后得到含铅的Na2SO4废液,需要进一步除去废水中的铅。
①常温下,该废液中![]() 浓度为0.01 mol·L1,则该废液中Pb2+浓度最大为_____________。[Ksp(PbSO4)=1.8×108]
浓度为0.01 mol·L1,则该废液中Pb2+浓度最大为_____________。[Ksp(PbSO4)=1.8×108]
②随温度升高和![]() 浓度增大废液中Pb2+浓度显著增大,所以工业通常采用向废液中加入Na2CO3、NaHCO3或NaOH等碱性沉淀剂产生Pb(OH)2沉淀除铅。废液随着pH的变化生成Pb(OH)2的质量如图2。向含铅废液中投放NaHCO3发生的离子方程式为_____________。在实际生产中采用NaHCO3或Na2CO3沉铅,不采用NaOH的原因是_____________。
浓度增大废液中Pb2+浓度显著增大,所以工业通常采用向废液中加入Na2CO3、NaHCO3或NaOH等碱性沉淀剂产生Pb(OH)2沉淀除铅。废液随着pH的变化生成Pb(OH)2的质量如图2。向含铅废液中投放NaHCO3发生的离子方程式为_____________。在实际生产中采用NaHCO3或Na2CO3沉铅,不采用NaOH的原因是_____________。

(3)电化学除铅。利用脉冲电源(间歇性通入电流)电解法转化废液中的Pb2+实现铅资源化利用,可以提高除铅效率(除铅效率与Pb2+浓度有关),其原理示意图3。
①写出阳极的电极反应式:__________。
②采用脉冲电解比普通电源电解的优点是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
(3)下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
(4)工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2﹣+NO3﹣+H2O和NO+NO2+2OH﹣=__+H2O(配平该方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HIn在水溶液中存在以下电离平衡:HIn(红色)![]() H+ + In-(黄色),故可用作酸碱指示剂。浓度为0.02 mol/L的下列各溶液:①盐酸,②石灰水,③NaCl溶液,④NaHSO4溶液,⑤Na2CO3溶液,⑥氨水,其中能使指示剂显红色的是
H+ + In-(黄色),故可用作酸碱指示剂。浓度为0.02 mol/L的下列各溶液:①盐酸,②石灰水,③NaCl溶液,④NaHSO4溶液,⑤Na2CO3溶液,⑥氨水,其中能使指示剂显红色的是
A. ①④⑤ B. ②⑤⑥ C. ①④ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.FeCl3溶液和Cu混合:FeCl3+Cu = Fe2++Cu2+ +3Cl-
B.甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH﹣![]() HCOO﹣+NH
HCOO﹣+NH![]() +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O
C.碳酸氢钠的水解方程式:HCO![]() +H2O
+H2O![]() CO
CO![]() +H3O+
+H3O+
D.Ca(HCO3)2溶液中加入过量氨水:Ca2++2HCO![]() +2NH3H2O=CaCO3↓+2H2O+2NH
+2NH3H2O=CaCO3↓+2H2O+2NH![]() +CO
+CO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com