
【题目】随着社会的发展,人类日益重视环境问题,下列做法正确的是
A.采用“绿色化学”工艺,使原料尽可能完全转化为所需要的物质
B.大量使用农药和化肥,提高农作物的产量
C.将氟利昂大量用于冰箱、空调的制冷剂
D.将废弃的植物油(即“地沟油”)蒸馏可以重新作为食用油
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】实验室需要配制0.55mol·L-1NaOH溶液220mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、。
(2)计算。配制该溶液需取NaOH晶体。
(3)称量。
①天平调平后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:![]() (1g以下用游码):
(1g以下用游码):
②称量过程中NaOH晶体应放于天平的(填“左盘”或“右盘”)。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 。
(5)转移、洗涤。在转移时应使用玻璃棒引流,应注意;需要洗涤烧杯2~3次是为了 。
(6)定容、摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明溶液名称、浓度及配制的时间。
(8)下列操作使所配溶液浓度偏大的有(填字母,下同);无影响的有。
A.称量时用生锈的砝码 |
B.将NaOH放在纸上称量 |
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
D.往容量瓶转移时有少量液体溅出 |
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥就用来配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
| 2.24L | 3.36L | 3.36L |
A.盐酸的物质的量浓度为5.0mol·L-1
B.根据表中数据计算出混合物中NaHCO3的物质的量分数为50%
C.9.2g混合物中NaHCO3和KHCO3分别为5.0g和4.2g
D.15.7g混合物恰好与盐酸完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转换关系如下图,反应的条件和部分产物已略去。回答下列问题:

(1)若甲、乙是两种常见金属,反应Ⅲ的实验现象是苍白色火焰,瓶口出现白雾。
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种强腐蚀性的物质,则工业上生产甲的一般方法是______。(填序号)
A.热分解法
B.热还原法
C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是_______________________。
③通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性______(填“强”或“弱”),比较二者金属性强弱的依据还可以是__________________(写出一种即可)。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应Ⅲ的离子方程式是_____________________。
②反应I的另一种产物为有机物,则该有机物的电子式是___________。
③已知次氯酸的酸性弱于碳酸,则在饱和氨水中加入少量石灰石,其反应的离子方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】13.0 g Zn与200 mL 1.5 mol·L-1 H2SO4溶液充分反应后,所得溶液中的溶质是______________(填化学式),其中阳离子的物质的量浓度为____________(忽略反应前后溶液体积变化);实验室用氯酸钾和二氧化锰制氧气,______________元素被还原,当有224 mL(标准状况下)O2生成时,电子转移的数目为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是

A. 图1中电解质溶液的pH增大
B. 图2中电解AlCl3溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. A处通入的气体为CH4,电极反应式为CH4+10OH--8e-=CO32-+7H2O
D. 电解池中Cl-向x极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸 (H2C2O4)在60℃时反应制得,某学生拟用下图所示的装置模拟制取并收集ClO2。
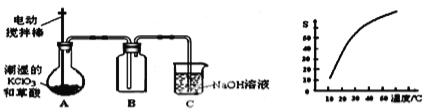
(1)B必须放在冰水浴中控制温度,其原因是_______________。
(2)反应后在装置C中可得NaClO2溶液.已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO23H2O,在温度高于38℃时析出晶体是NaClO2 。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a______;b_______;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
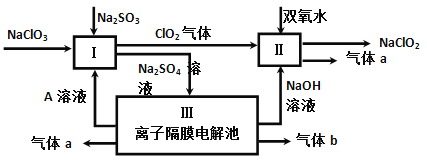
①I、III中发生反应的还原剂分别是_____、_____(填化学式)。
②Ⅱ中反应的离子方程式是___________。
③ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式______。
④NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量_______。(填“相同”,“不同”或“无法判断”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成细胞的微量元素的说法,不正确的是( )
A. 通常指生物生活所必需的,但需要量却很少的一些元素
B. 生物体中可以有,也可以没有的一些元素
C. 微量元素是细胞维持正常生命活动不可缺少的元素
D. Cu、Zn、Mo等元素是细胞内的微量元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com