
【题目】[化学—选修物质结构与性质]
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为 ,基态Fe原子的价电子排布式为 。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是 ,Fe(CO)5在空气中燃烧后剩余固体呈红棕色,其化学方程式为 。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是 ,配体中提供孤对电子的原子是 。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有 形成。
a.离子键 b.配位键 c.非极性键 d.б键
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为 ,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为 (写出已化简的比例式即可)。

【答案】(1)O>N>C; 3d64s2
(2)分子晶体 ![]()
(3)sp2、sp3 N
(4)bd
(5)2:1 ![]()
【解析】
试题分析:(1)同周期由左向右元素的电负性呈递增趋势,C、N、O的电负性由大到小的顺序为O>N>C,铁为26号元素,根据构造原理确定,基态Fe原子的价电子排布式为3d64s2。
(2)根据题意知Fe(CO)5又名羰基铁,常温下为黄色油状液体,熔点较低,则Fe(CO)5的晶体类型是分子晶体,Fe(CO)5在空气中燃烧生成氧化铁和二氧化碳,化学方程式为![]() 。
。
(3)配合物[Cu(NH3)2]OOCCH3中,酯基中碳原子的杂化类型是sp2,甲基中碳原子的杂化类型是sp3,配体中提供孤对电子的原子是N原子。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有配位键、б键形成,选bd。
(5)根据晶胞结构利用切割法分析,面心立方晶胞中含有的铁原子个数为:8×1/8+6×1/2=4,体心立方晶胞中含有的铁原子数目为:8×1/8+1=2,实际含有的铁原子个数之比为2:1;设铁原子半径为r,面心立方堆积晶胞的棱长为a1,则![]() a1=4r,体心立方堆积晶胞的棱长为a2,则
a1=4r,体心立方堆积晶胞的棱长为a2,则![]() a2=4r,两种铁晶体的密度之比为
a2=4r,两种铁晶体的密度之比为![]() 。
。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
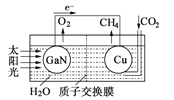
(1)科学家用氮化镓材料与铜组装如右图的人工光合系统, 利用该装置成功地实现了以CO2和H2O合成CH4。
①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”)。
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 。
2CO(g)+2H2(g) 。
①该反应的平衡常数表达式为 。
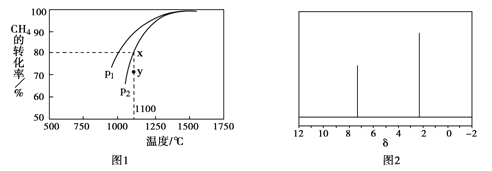
②在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“>”或“<”);压强为P2时,在Y点:v(正) v(逆)(填“>”、“<”或“=”)。
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如下图2,则X的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行了如下实验。
【分子式的确定】
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况)。则该有机物中各元素的原子个数比是 。
(2)该有机化合物的相对分子质量为46,则其分子式是 。
(3)预测A的可能结构并写出结构简式 。
【结构简式的确定】
(4)经测定,在标准状况下0.2mol有机物A与足量金属钠反应生成2.24L的氢气,则A的结构简式为 。理由__________________。
【性质实验】
(5)A在一定条件下脱水可生成B,用B制备氯乙烷原子利用率为100%,请写出上述由B制备氯乙烷反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、环境等社会实际密切相关。下列叙述正确的是
A.“滴水石穿、绳锯木断”不涉及化学变化
B.明矾净水的原理和“84”消毒液消毒的原理不相同
C.氟利昂作制冷剂会加剧雾霾天气的形成
D.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是

A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.标准状况下若生成2.24LN2则转移电子为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中,不正确的是
A.FeSO4 可用于防止食品氧化变质,延长食品的保质期
B.向Fe2(SO4)3 溶液中加入一定量的铜粉,铜粉全部反应后,溶液中一定含有Fe2+
C.物质NaHCO3、Al2O3、Fe2O3、Al(OH)3、Al 都既能跟盐酸反应, 又能跟氢氧化钠溶液反应
D.铁在氧气中燃烧,生成黑色的Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷(CH3C1)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
(1)甲组同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷。
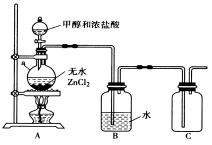
① 无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为____________________________。
② 装置B的主要作用是____________________。
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol·L-1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol·L-1盐酸标准液对吸收液进行返滴定(发生的反应为:
NaOH+HCl= NaCl+H2O ,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2 mL盐酸。则所收集CH3Cl的物质的量为_____ _ mol。(已知:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
(2)乙组同学选用甲组A、B装置和下图所示的部分装置检验CH3Cl中的氯元素。
(已知:一卤代烷一般要在加热条件下才能与氢氧化钠溶液反应)
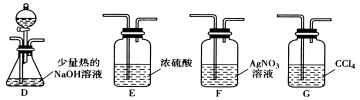
①乙组同学的实验装置中,依次连接的合理顺序为A→B→________→__ → 。
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞,观察实验现象。分液漏斗中盛放的试剂是_______和_________。
③能证明CH3Cl中含有氯元素的实验现象是_____________________________。
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子。相关数据如下表:

①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式:______________________________。
②将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的保存方法正确的是( )
A. 用橡皮塞把液溴密封于玻璃瓶中
B. 用磨口玻璃塞把氢氟酸密封于棕色试剂瓶中
C. 把氯气加压液化后密封于钢瓶中
D. 氯水通常保存于无色试剂瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com