
| 步骤 | 实验操作 | 现象记录 |
| 1 | 将1g细铜丝放入盛有10mL1mol•L-1HNO3的试管中加热 | 铜丝表面有无色气体逸出,溶液变成天蓝色 |
| 2 | 将1g细铜丝放入盛有10mL的14mol•L-1HNO3的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色. |
| 3 | 将硝酸铜晶体配成饱和溶液 | 深蓝色溶液 |
| 4 | 向饱和的硝酸铜溶液中不断滴加14mol•L-1HNO3 | 溶液仍呈深蓝色 |
分析 (1)根据实验记录和已知信息“Cu2+可以和NH3形成类似[Ag(NH3)2]+的复杂分子[Cu(NH3)4]2+,NH3分子可以换成气体分子或离子”可知判断所得溶液呈天蓝色的化学粒子符号;
(2)与(1)对比:饱和硝酸铜溶液中c((NO3-)大,根据已知信息推测使饱和硝酸铜溶液呈深蓝色的化学粒子符号;
(3)根据浓硝酸与铜丝反应产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色可知,Cu(NO3)2溶液的绿色是由蓝色的Cu(NO3)2溶液和黄色的HNO3溶液(溶有NO2)的两者混合而成的;可以通过向饱和的硝酸铜溶液中通入大量的NO2气体或将浓硝酸与铜丝反应后的溶液加热或用水稀释等方法进行证明.
解答 解:(1)根据实验记录和已知信息“Cu2+可以和NH3形成类似[Ag(NH3)2]+的复杂分子[Cu(NH3)4]2+,NH3分子可以换成气体分子或离子”可知:稀硝酸与铜丝反应后,所得溶液呈天蓝色的化学粒子符号是:[Cu(H2O)4]2+,
故答案为:[Cu(H2O)4]2+;
(2)与(1)对比:饱和硝酸铜溶液中c((NO3-)大,根据已知信息推测:使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是:[Cu(H2O)4-x(NO3)x](2-x)(1<x<4),
故答案为:[Cu(H2O)4-x(NO3)x](2-x)(1<x<4);
(3)由实验记录:浓硝酸与铜丝反应产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色,由此可见,Cu(NO3)2溶液的绿色是由蓝色的Cu(NO3)2溶液和黄色的HNO3溶液(溶有NO2)的两者混合而成的;验证方案:方案①向饱和的硝酸铜溶液中通入大量的NO2气体;方案②将浓硝酸与铜丝反应后的溶液加热;方案③用水稀释,
故答案为:可能是还原产物NO2溶入其中引起的;方案①向饱和的硝酸铜溶液中通入大量的NO2气体;方案②将浓硝酸与铜丝反应后的溶液加热;方案③用水稀释.
点评 本题考查了性质实验方案的设计,题目难度中等,明确题中信息为解答关键,注意熟练掌握性质实验方案设计与评价的原则,试题侧重考查学生的分析、理解能力及灵活应用能力.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 蛋白质都属于天然有机高分子化合物,且都不溶于水 | |
| B. | 用灼烧闻气味的方法可以区别人造丝(纤维素)和蚕丝 | |
| C. | 人体内不含纤维素水解酶,人不能消化纤维素,因此蔬菜中的纤维素对人没有用处 | |
| D. | 油脂是一种高分子化合物,可水解为甘油和高级脂肪酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙醇发生了还原反应 | B. | 反应中有红黑颜色交替变化的现象 | ||
| C. | 铜是此反应的催化剂 | D. | 生成物是乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 弱酸 | HClO2 | HF | HCN | HS |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
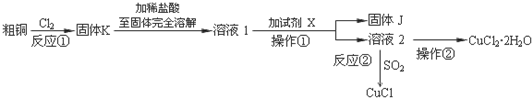
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①Na,K,Rb ②N,P,As ③O,S,Se ④Na,P,Cl元素的电负性随原子序数增大而递增的是④ | |
| B. | 下列原子中,①1s22s22p63s23p1②1s22s22p63s23p2③1s22s22p63s23p3④1s22s22p63s23p4对应的第一电离能最大的是④ | |
| C. | 某元素的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,该元素在第三周期第 IIA族 | |
| D. | 以下原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22 s22p63s23p4半径最大的是① |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 能源与资源是现代社会发展的重要支柱.
能源与资源是现代社会发展的重要支柱.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28gN2含有的原子数为2NA | |
| B. | 1mol•L-1AlCl3溶液中含有的Cl-数为3NA | |
| C. | 标准情况下,2.24LCCl4含有的分子数NA | |
| D. | 常温常压下,22.4LCl2与足量铁充分反应,转移电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com