
通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO 的原理如图1,A为电源的 极,阴极反应式为 。
的原理如图1,A为电源的 极,阴极反应式为 。


(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
【知识点】热化学方程式的书写 电解原理 难溶物的沉淀溶解平衡F1 F4 H5
【答案解析】(1)2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=-746.5KJ/mol
(2)1:3(3)正极;2NO3-+12H++10e-=N2↑+6H2O(4)①Cr(OH)3、C ②1×10-15
解析:(1)N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol①
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol②
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ③
方程式③×2-②-①得NO (g)+2CO(g)=N2(g)+2CO2(g)
所以△H=(-393.5kJ/mol)×2-(-221.0kJ/mol)-(+180.5kJ/mol)=-746.5 kJ/mol;
(2)根据反应可知:氨气被氧化为氮气,二氧化氮被还原为氮气
设一氧化氮体积为x,二氧化氮体积为3-x,氨气的体积为3.5L,根据电子守恒可知:3.5L×3=2x+4×(3-x),
x=0.75L,二氧化氮体积为2.25L,相同条件下,混合气体中NO和NO2的体积比等于物质的量之比为:0.75:2.25=1:3;
(3)由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极,在阴极反应是NO3-得电子发生还原反应生成N2,所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2+6H2O;
(4)①图象分析判断,相同条件下,Fe(OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是Cr(OH)3;曲线上的点为饱和溶液,曲线左边是未饱和溶液,右边为过饱和溶液,C点为过饱和溶液要有固体析出,其溶质的沉淀速率大于溶解速率;
②由图象可知,当PH=9时,c(Fe2+)=1×10-5mol•L-1,Ksp=c(Fe2+)•c2(OH-)=1×10-5×(1×10-5)2 =1×10-15,
【思路点拨】本题考查了热化学方程式的书写、电解原理及电极反应书写、难溶物的沉淀溶解平衡等知识,试题涉及的知识点较多、综合性强,熟练掌握基本知识并能灵活应用是解题的关键。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
将等质量的锌粒(wg)分别投入VL pH=2的盐酸和醋酸(含醋酸n mol),结果发现一种溶液中Zn有剩余,有关叙述正确的是( )
|
| A. | 0.325V<w<32.5n |
|
| B. | 产生H2的平均反应速率盐酸大于醋酸 |
|
| C. | 产生H2的量盐酸多于醋酸 |
|
| D. | 与醋酸反应时锌有剩余 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1﹣丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )
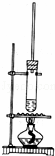
|
| A. | 不能用水浴加热 |
|
| B. | 长玻璃管有冷凝回流作用 |
|
| C. | 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 |
|
| D. | 加入过量乙酸可以提高1﹣丁醇的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了比较①H﹣OH,②CH3COOH,③CH3CH2﹣OH,④H2CO3,⑤苯酚五种物质分子中﹣OH上氢原子的活动性顺序,某课外活动小组设计了如下表所示的实验方案.请你利用有关实验仪器及给出的试剂,填写表中的空格,完成上述实验方案.可供选用的试剂有:紫色石蕊试液、金属钠、氢氧化钠溶液、碳酸钠溶液.实验中所需仪器自选.
| 实验步骤和操作 | 实验现象 | 结论(﹣OH上氢原子活动性顺序) |
| (1)五种物质各取少量于五支试管中,各加入紫色石蕊试液2~3滴 | ②④变红,其它不变 | ②、④>①、③、⑤ |
| (2) | ||
| (3)①、③、⑤各取少量于试管中,各加入少量NaOH溶液 | ⑤由浑浊变澄清 | ⑤>①、③ |
| (4) |
(5)通过以上实验比较,从而得出这五种物质分子中﹣OH上氢原子的活动性由强到弱的顺序为 (填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10-12,取适量的MgCl2溶液,
加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
A.所得溶液中的c (H+)=10-13mol/L
B.所得溶液中由水电离产生的c (OH-)=10-13 mol/L
C.所加的烧碱溶液的pH=13.0
D.所得溶液中的c (Mg2+)=5.6×10-10 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知汽车尾气无害化处理反应为2NO(g)+2CO(g)N2(g)+2CO2(g)。下列说法不正确的是( )
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,在2X(g)+Y(g)2Z(g)的平衡体系中,X、Y、Z的浓度分别是2 mol·L-1,0.8 mol·L-1,2.4 mol·L-1,则Y在起始时的浓度可能是( )
A.0.8~2 mol·L-1 B.0~2 mol·L-1
C.0~0.8 mol·L-1 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的KHSO4溶液。当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与KHSO4溶液的体积之和,则Ba(OH)2溶液与KHSO4溶液的体积比是( )
A.1∶9 B.1∶1 C.1∶2 D.1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
对于某些离子的检验及结论一定正确的是( )
|
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32﹣ |
|
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣ |
|
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
|
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com