
| ʵ���� | HA���ʵ��� Ũ�ȣ�mol/L�� | NaOH���ʵ� ��Ũ�ȣ�mol/L�� | �����Һ��pH |
| �� | 0.2 | 0.2 | pH=a |
| �� | c1 | 0.2 | pH=7 |
| �� | 0.2 | 0.1 | pH��7 |
| �� | 0.1 | 0.1 | pH=9 |
���� I����1����pH��ֽ�ⶨ��ҺpHֵ��
��2����������ˮ���룬��Һ���Ի����ԽС��ˮ�ĵ���̶�Խ��
��3�����HAΪ���ᣬ������м�������PH=2�������������Һ��Ϻ���ҺpH��ȻΪ2�����������غ��ж�����Ũ�ȴ�С��
��4�����HAΪǿ�ᣬMOHΪǿ��ٺ͢�������Һ���ʵ���Ũ�ȶ���0.01mol/L���Ѣٺܰ͢������1��4��ϣ�MOH��ʣ�࣬��Һ�ʼ��ԣ������Һ��c��OH-��=$\frac{0.01mol/L����4-1��}{4+1}$=0.006mol/L��c��H+��=$\frac{1{0}^{-14}}{c��O{H}^{-}��}$��
II����1���ɶ���֪������ǡ�÷�Ӧ����NaA����Һ��pH=9��
��2���ɶ���֪������ǡ�÷�Ӧ����NaA����Һ��pH=9��HAΪ���ᣬ����Һ�в��ֵ��룻
��3���ɶ���֪��HAΪ���ᣬ��Ӧ����Һ�����ԣ�c1����0.2��
��� �⣺I����1����pH��ֽ�ⶨ��ҺpHֵ������������Ϊ���ڱ�������Ƭ���Ϸ�һСƬ��ֽ���ò�����պȡ��������Һ���ڸ����pH��ֽ�ϣ������ɫ���Ա���ȷ��pH��
�ʴ�Ϊ���ڱ�������Ƭ���Ϸ�һСƬ��ֽ���ò�����պȡ��������Һ���ڸ����pH��ֽ�ϣ������ɫ���Ա���ȷ��pH��
��2����������ˮ���룬��Һ���Ի����ԽС��ˮ�ĵ���̶�Խ����Һ�ʼ��ԡ�����Һ�����Ի���ԣ���ʹ��Һ�ʼ��ԣ������С�ڢܣ�������ˮ����̶ȣ��ܣ��ޣ���ˮ�ĵ������̶Ȣܣ��ޣ�
�ʴ�Ϊ������
��3�����HAΪ���ᣬ������м�������PH=2�������������Һ��Ϻ���ҺpH��ȻΪ2��
����Һ��c��Cl-����c��A-�� ����С����Һ��c��OH-�� ��С����������Ũ�ȴ�С˳����c��H+����c��Cl-��=c��A-����c��OH-����
�ʴ�Ϊ��c��H+����c��Cl-��=c��A-����c��OH-����
��4�����HAΪǿ�ᣬMOHΪǿ��ٺ͢�������Һ���ʵ���Ũ�ȶ���0.01mol/L���Ѣٺܰ͢������1��4��ϣ�MOH��ʣ�࣬��Һ�ʼ��ԣ������Һ��c��OH-��=$\frac{0.01mol/L����4-1��}{4+1}$=0.006mol/L��c��H+��=$\frac{1{0}^{-14}}{c��O{H}^{-}��}$=$\frac{1{0}^{-14}}{0.006}$=$\frac{1}{6}$��10-11mol/L����pH=11.8��
�ʴ�Ϊ��11.8��
II����1���ɶ���֪������ǡ�÷�Ӧ����NaA����Һ��pH=9��˵��HAΪ���ᣬ���Ũ�ȵ������NaOH����NaA��NaA����Һ��ˮ�⣬��Һ��pH��7��
�ʴ�Ϊ������
��2���ɶ���֪������ǡ�÷�Ӧ����NaA����Һ��pH=9��HAΪ���ᣬ����Һ�в��ֵ��룬����뷽��ʽ��H?H++A-��
�ʴ�Ϊ��H?H++A-��
��3���ɶ���֪��HAΪ���ᣬ��Ӧ����Һ�����ԣ�˵��c1����0.2��
�ʴ�Ϊ������
���� ���⿼��������ʵĵ��룬�漰pH���㡢����Ũ�ȴ�С�Ƚϡ�������ʵĵ����֪ʶ�㣬��Ŀ�Ѷ��еȣ�ע������������ݣ���������ʵĵ��������ˮ��ĽǶȽ��ѧϰ��ע����ع��ɺͷ����Ļ��ۣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2L0.5mol/L����������Һ�к��е�H+������Ϊ2NA | |
| B�� | 2.0 gH218O��D2O�Ļ����������������ΪNA | |
| C�� | ��⾫��ͭʱ���������������64g���������õ��ĵ�����Ϊ2NA | |
| D�� | 1L 0.1 mol/L��NaHCO3��Һ��HCO3-��CO32-��������Ϊ0��l NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10 s | B�� | 12 s | C�� | ����12 s | D�� | ��12 s |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
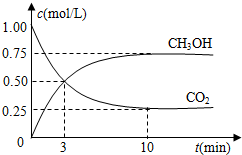
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �� | H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=-242kJ/mol�� |
| �� | 2H2��g��+O2��g���T2H2O��l����H=-572kJ/mol�� |
| �� | C��s��+$\frac{1}{2}$O2��g���TCO��g����H=-110.5kJ/moL�� |
| �� | C��s��+O2��g���TCO2��g����H=-393.5kJ/moL�� |
| �� | CO2��g��+2H2O��g���TCH4��g��+2O2��g����H=+802kJ/moL |
| ��ѧ�� | O=O | C-C | H-H | O-O | C-O | O-H | C-H |
| ����kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 |
| A�� | H2ȼ���ȵ��Ȼ�ѧ����ʽΪH2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=-242kJ/mol | |
| B�� | �Ȼ�ѧ����ʽ��C��s��+H2O��g��?H2��g��+CO��g����H=+175.5kJ/moL | |
| C�� | CH4��ȼ���ȡ�H=-802kJ/moL | |
| D�� | �����C=O����Ϊ800kJ/moL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ۢܢ� | C�� | �ڢۢ� | D�� | �٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ۢܢ� | C�� | �ڢܢ� | D�� | �ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4molA+2molB | B�� | 3molB+1molD | ||
| C�� | 2molA+1molB+3molC | D�� | 1molA+0.5molB+1.5molC+0.6molD |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ��ʾ��װ�ã���ͨ��Դ5min�缫3������������0.64g��
��ͼ��ʾ��װ�ã���ͨ��Դ5min�缫3������������0.64g���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com