
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。下列说法错误的( )
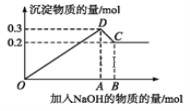
A.C点溶液中溶质为偏铝酸钠和氯化钠
B.原溶液中Mg2+、Al3+的物质的量浓度之比为 2∶1
C.C点加入0.8mol NaOH
D.图中线段OA∶AB=5∶1
【答案】D
【解析】
A.由图象可知,0~A发生Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,A~B发生Al(OH)3+OH-═AlO2-+2H2O,则C点对应的沉淀为Mg(OH)2,溶液中的溶质为NaAlO2和NaCl,故A正确;
B.C点对应的沉淀为Mg(OH)2,D点对应的沉淀为Mg(OH)2和Al(OH)3,则Mg(OH)2的物质的量为0.2mol,Al(OH)3的物质的量为0.3mol-0.2mol=0.1mol,由Mg(OH)2~Mg2+、Al(OH)3~Al3+,溶液的体积相同,浓度之比等于物质的量之比,则原溶液中Mg2+、Al3+物质的量浓度之比为0.2mol:0.1mol=2:1,故B正确;
C.由选项B的解析可知:Mg2+的物质的量为0.2mol、Al3+的物质的量为0.1mol,则溶液中Cl-为0.2mol×2+0.1mol×3=0.7mol,C点对应溶液中的溶质为NaAlO2和NaCl,则n(Na+)=0.1mol+0.7mol=0.8mol,即C点加入0.8mol NaOH,故C正确;
D.0~A发生Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓;A~B发生Al(OH)3+OH-═AlO2-+2H2O,则线段OA对应的NaOH的物质的量为0.4mol+0.3mol=0.7mol,线段AB对应的NaOH的物质的量为0.1mol,故线段OA:AB=0.7mol:0.1mol=7:1,故D错误;
故答案为D。


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Zn(s) +![]() O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
Hg(l) +![]() O2(g) = HgO(s) ΔH2=-90.7kJ/mol
O2(g) = HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中ΔH3的值是
A.-260.4 kJ/molB.-254.6 kJ/molC.-438.9 kJ/molD.-441.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4
b.含有FeSO4和Fe2(SO4)3
c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
实验序号 | 操作 | 现象 |
ⅰ | 取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液 | 产生红褐色沉淀 |
ⅱ | 取2 mL溶液X,加入1滴KSCN | 溶液显红色 |
(1)请用文字表述做出假设b的依据是__________________________。
(2)对实验ⅰ的预期现象是产生白色沉淀、变为灰绿色、最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表达)_____、_____。
(3)由实验ⅱ得出的结论是____________。结合实验ⅰ、ⅱ,推测实验ⅰ实际现象与预期现象不符的原因可能是_____________________________。为进一步验证假设,小组同学进行了以下实验:
实验序号 | 操作 | 现象 |
ⅲ | 取2 mL溶液X,加入1滴KSCN,再加入1 mL水 | 溶液显红色 |
ⅳ | 取2 mL溶液X,加入1滴KSCN,再加入1 mL氯水 | 溶液显红色,颜色比ⅲ深 |
(4)实验ⅳ中氯水参加反应的离子方程式是_______________________。
(5)通过以上实验,可得到的结论是_____________________________,请完整表达该结论是如何得出的_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属A能够被磁铁所吸引.A及其A的化合物之间有如下的转化关系:
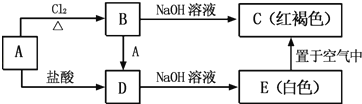
(1)写出A、C的化学式:A_____;C_____.
(2)检验B中阳离子的试剂是_____.
(3)写出下列反应的化学方程式或离子方程式:
A→D 的离子方程式_____
E→C 的化学方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
A. 处于平衡状态,正逆反应速率相等B. 改变条件后,化学平衡常数一定改变
C. 反应逆向进行,正反应速率小于逆反应速率D. 升高温度,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积的关系如图所示(不考虑CO2在水中的溶解)。
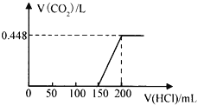
(1)写出 0~150mL 段发生反应的离子方程式为:____________;150mL ~200mL段发生反应的离子方程式为:___________________;
(2)所用盐酸的物质的量浓度为_______________;
(3)将上述氢氧化钠固体样品溶于水,所形成溶液的溶质为___________、_________(写化学式),其物质的量分别为 ____________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温密闭容器中发生反应:CaCO3(s)![]() CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是( )
CaO(s)+CO2(g) H>0,反应达到平衡后,tl时缩小容器体积, x随时间(t)变化的关系如下图所示。x不可能是( )
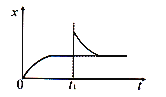
A. υ逆(逆反应速率)B. ρ(容器内气体密度)
C. m(容器内CaO质量)D. p(容器压强)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.50 g 34%H2O2溶液中含H-O键的数目为NA
B.180 g淀粉完全水解生成葡萄糖的分子数为NA
C.1 L 0.1 mol·L-1K2SiO3溶液中含SiO32-的数目为0.1NA
D.反应5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O,每生成1 mol ClO2转移电子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒.已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.
(1)上述反应中氧化剂是___________.
(2)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:①碘化钾淀粉试纸、②淀粉、③白酒、④食醋,你认为必须选用的物质有__________(填序号).
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________(填编号).
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平化学方程式:___Al+___NaNO3+___NaOH═___NaAlO2+___N2↑+___H2O.
若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com