
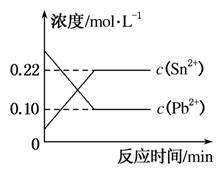
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s)
体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
下列判断正确的是( )
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25 ℃时,该反应的平衡常数K=2.2
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
下列实验,能获得成功的是( )
A.用溴水鉴别苯、乙醇、苯乙烯
B.苯、溴水、铁粉混合制溴苯
C.用分液漏斗分离苯和乙醇
D.加浓溴水,然后过滤除去苯中混有的少量己烯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件的改变都能使化学反应:A(g)+B(g)C(g)+D(g)的反应速率发生改变,但其中变化的实质与“浓度改变对反应速率影响”相同的是( )
A.光照 B.温度
C.压强 D.催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
某些化学键的键能如下表(kJ·mol-1):
| 键 | H—H | Br—Br | I—I | Cl—Cl | H—Cl | H—I | H—Br |
| 键能 | 436.4 | 193 | 151.1 | 242.7 | 431.8 | 298.7 | 356 |
(1)1 mol H2在2 mol Cl2中燃烧,放出热量________kJ。
(2)在一定条件下,1 mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的顺序是_____________________________________
预测1 mol H2在足量F2中燃烧比在Cl2中放热________(填“多”或“少”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.ΔH>0、ΔS>0的反应一定不能自发进行
B.反应4Al(s)+3O2(g)===2Al2O3(s)的ΔH<0、ΔS>0
C.反应物分子有效碰撞次数增加则反应物的浓度一定增加
D.压强和浓度对反应速率的影响都是通过改变单位体积活化分子数从而影响有效碰撞次数来实现的
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积恒定的密闭容器中,一定量的SO2与1.100 mol O2在催化剂作用下加热到600 ℃发生反应:2SO2+O2 2SO3 ΔH<0。当气体的物质的量减少0.315 mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
2SO3 ΔH<0。当气体的物质的量减少0.315 mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B.降低温度,正反应速率减小程度比逆反应速率减小程度大
C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980 g
D.达到平衡时,SO2的转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是( )
A.原子核外每层最多容纳的电子数为2n2个(n为电子层)
B.同一原子核外的M层上的电子数一定比L层上的电子数多
C.如果原子只有一个电子层,该原子的质子数不超过2个
D.1~18号元素,每层电子数都满足2n2个电子的元素只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F为原子序数依次增大的同周期的主族元素,已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3。请回答下列问题:
(1)写出下列元素的符号:B________、D________、E________。
(2)写出B、F形成的化合物的电子式________________________________________________________________________。
(3)A、C两种元素最高价氧化物的水化物反应的离子方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3 粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2 溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com