
熔融碳酸盐(如熔融K2CO3)环境下
负极:________________________________________________________________________;
正极:________________________________________________________________________;
总反应式:______________________________________________________________。
科目:高中化学 来源: 题型:
原子数相同、电子总数相同的粒子,互称为等电子体。硼元素可形成三个等电子体阴离子:BO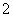 、BC
、BC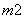 和BN
和BN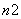 ,则m、n值为( )
,则m、n值为( )
A.5、3 B.2、4 C.3、1 D.1、2
查看答案和解析>>
科目:高中化学 来源: 题型:
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法探究影响化学反应速率的因素。
实验一:利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案,研究影响反应速率的因素。
(1)甲同学的实验报告如表所示:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取三份等体积的2 mol·L-1 硫酸于试管中 ②分别投入大小、形状相同的 Cu、Fe、Mg | 反应产生气泡的速率大小: Mg>Fe>Cu | 反应物的性质越活泼,反应速 率越大 |
该同学的实验目的是__________________,要想得出正确的实验结论,还需要控制的实验条件是________________________________________________________________________。
(2)乙同学为了能精确地研究浓度对反应速率的影响,在相同温度下利用如图所示装置进行定量实验。完成该实验应选用的实验药品是__________,应该测定的实验数据是________________________________________________________________________。
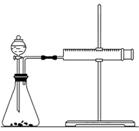
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内反应速率较小,溶液褪色不明显,但反应一段时间后,溶液突然褪色,反应速率明显增大。
(3)针对上述实验现象,某同学认为该反应放热,导致溶液的温度升高,从而使反应速率增大。从影响化学反应速率的因素看,你认为还可能是________的影响。
(4)若要用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还可以在反应开始时加入________(填字母)。
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg===Mg2++2Ag+2Cl-
试书写该电池的正、负极电极反应式。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)( )

A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端低B端高
D.当杠杆为导体时,A端高B端低
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:
Ni(OH)2+M===NiOOH+MH
已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO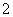
下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程中OH-离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)分析如图所示的四个装置,请回答下列问题:

①装置a和b中铝电极上的电极反应式分别为___________________、_______________。
②装置c中产生气泡的电极为________电极(填“铁”或“铜”),装置d中铜电极上的电极反应式为__________________________________。
(2)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为_____________________________、__________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
实验:①0.1 mol·L-1MgCl2溶液和0.2 mol·L-1NaOH溶液等体积混合得到浊液a,取少量浊液a过滤得到滤液b和白色沉淀c;②向浊液a中滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀。下列分析不正确的是( )
A滤液b的pH=7
B.②中颜色变化说明Mg(OH)2转化为Fe(OH)3
C.实验可以证明Fe(OH)3的溶解度比Mg(OH)2的小
D.浊液a中存在沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com