
| A. | 元素周期表中有18列,即18个族 | |
| B. | 目前使用的元素周期表中,最长的周期含有32种元素 | |
| C. | 短周期元素是指1~20号元素 | |
| D. | 原子的种类和元素的种类一样多 |
分析 A、元素周期表有18个列,但有16个族;
B、根据元素周期表各周期元素的种类判断;
C、短周期元素是指1~18号元素;
D、一种元素可能有多种原子.
解答 解:A、元素周期表有18个列,但有16个族,7个主族、7个副族、1个零族、1个ⅤⅢ族,故A错误;
B、元素周期表共有7个周期,第7周期没有排满,1~6周期元素种类分别为2、8、8、18、18、32种,故最长的周期含有32种元素,故B正确;
C、短周期元素是指第一、二、三周期元素,是1~18号元素,故C错误;
D、一种元素可能有多种原子,所以原子的种类比元素的种类多,故D错误;
故选B.
点评 本题考查元素周期表的结构、物质结构等,比较基础,注意整体把握元素周期律,掌握物质的特殊性.


科目:高中化学 来源: 题型:解答题
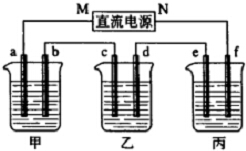 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 葡萄糖和蔗糖 | B. | 蔗糖和麦芽糖 | ||
| C. | 甲酸甲酯(HCOOCH3)和乙酸(CH3COOH) | D. | 淀粉和纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
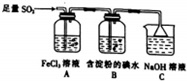
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 离子半径:C2->D->B+>A2+ | D. | 单质的还原性:A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

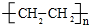 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “液氯”是纯净物而“氯水”是混合物 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | NO2溶于水发生了氧化反应,它既是氧化剂又是还原剂 | |
| D. | 用玻璃棒分别蘸取浓盐酸和浓氨水并互相靠近,能看到白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
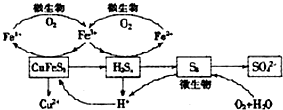
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com