
分析 原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z 为地壳中含量最多的元素,则Z为O元素;Z、W 位于同主族,则W为S元素;Y、Z 左右相邻,Y的原子序数小于O,则Y为N元素;M 元素与X 同主族,M的原子序数大于O,则M为Na元素;
(6)由H、N、O、S和Fe五种元素组成的相对分子质量为392的化合物C,1mol C中含有6mol结晶水,向C的溶液中加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味的气体,白色沉淀迅速变为灰绿色,最终变为红褐色,说明C中含有Fe2+和NH4+,另取少量C的溶液,向其中加入过量BaCl2溶液时产生白色沉淀,再加入稀盐酸沉淀不溶解,说明C中含有SO42-,设C的化学式为x(NH4)2SO4•yFeSO4•6H2O,则:(96+36)x+(96+56)y+108=392,则x=y=1,故C化学式为(NH4)2SO4•FeSO4•6H2O,据此进行解答.
解答 解:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z 为地壳中含量最多的元素,则Z为O元素;Z、W 位于同主族,则W为S元素;Y、Z 左右相邻,Y的原子序数小于O,则Y为N元素;M 元素与X 同主族,M的原子序数大于O,则M为Na元素,
(1)由上述分析可知,M为Na元素,原子序数为11,位于周期表中第三周期ⅠA族,
故答案为:第三周期ⅠA族;
(2)Z、W分别为O、S元素,非金属性O>S,非金属性越强,对应氢化物越稳定,则氢化物稳定性大小为:H2O>H2S,
故答案为:H2O;H2S;
(3)Y2X4为N2H4,YZ2为NO2,二者发生反应的化学方程式为:2N2H4(g)+2NO2(g)=3H2O(g)+4N2(g),该反应中生成4mol氮气转移了8mol电子,放出热量为:142kJ×8=1136kJ,则该反应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1136kJ•mol-1,
每转移 1mol 电子且生成气态 X2Z 放 出 142KJ 热量
故答案为:2N2H4(g)+2NO2(g)=2N2(g)+4H2O(g)△H=-1136kJ•mol-1;
(4)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,该酸为HNO3,Cu越稀硝酸反应得到硝酸铜、NO与水,反应离子方程式为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,
故答案为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑;
(5)由H、N、O、S四种元素组成的一种离子化合物A,为铵盐;
①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体,即氨气为2mol,即1molA含有2mol铵根离子;②A能与盐酸反应产生气体B,该气体能与氯水反应,B为二氧化硫,可推知A为(NH4)2SO3,二氧化硫有氯水反应得到HCl与硫酸,反应离子方程式为:SO2+Cl2+2H2O=4H++2Cl-+SO42-,
故答案为:(NH4)2SO3;SO2+Cl2+2H2O=4H++2Cl-+SO42-;
(6)由H、N、O、S和Fe五种元素组成的相对分子质量为392的化合物C,1mol C中含有6mol结晶水,向C的溶液中加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味的气体,白色沉淀迅速变为灰绿色,最终变为红褐色,说明C中含有Fe2+和NH4+,另取少量C的溶液,向其中加入过量BaCl2溶液时产生白色沉淀,再加入稀盐酸沉淀不溶解,说明C中含有SO42-,
①设C的化学式为x(NH4)2SO4•yFeSO4•6H2O,则:(96+36)x+(96+56)y+108=392,则x=y=1,故C化学式为:(NH4)2SO4•FeSO4•6H2O,
(NH4)2Fe(SO4)2中含有2个NH4+,2个SO42-和1个Fe2+,铵根离子、亚铁离子部分水解,溶液呈酸性,则c(H+)>c(OH-)、c(SO42-)>c(NH4+)>c(Fe2+),溶液中离子浓度大小为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),
故答案为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);
②(NH4)2Fe(SO4)2•6H2O与Na2O2按物质的量比1:2在溶液中反应,反应方程式为:4(NH4)2Fe(SO4)2•6H2O+8Na2O2=4Fe(OH)3+8NH3↑+3O2↑+8Na2SO4+22H2O,
故答案为:4(NH4)2Fe(SO4)2•6H2O+8Na2O2=4Fe(OH)3↓+8NH3↑+3O2↑+8Na2SO4+22H2O.
点评 本题考查位置结构性质的应用、无机物推断等,题目难度较大,明确Y、Z、W的位置及原子序数的关系来推断元素是关键,需要学生熟练掌握元素化合物性质,试题培养了学生的分析、理解能力及逻辑推理能力.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| B. | 28g乙烯和环丙烷(C3H6)组成的混合气体,完全燃烧时,转移的电子数为12NA | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中,所含NH4+数小于0.2NA | |
| D. | 标准状况下,2.24 L18O2中含有2NA个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再发生变化 | B. | 混合气体的颜色不再发生变化 | ||
| C. | 反应放出的热量恰好为9.4kJ时 | D. | 混合气体的压强不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
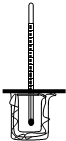 如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.
如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W的简单离子半径Z>W>Y | B. | 工业上制取Y可用电解YW3制得 | ||
| C. | XW2中各原子均达到8电子结构 | D. | Z、W的氧化物对应水化物的酸性Z<W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 改用50mL2mol/L盐酸 | ||
| C. | 改用200mL1mol/L盐酸 | D. | 用等量铁粉代替铁片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com